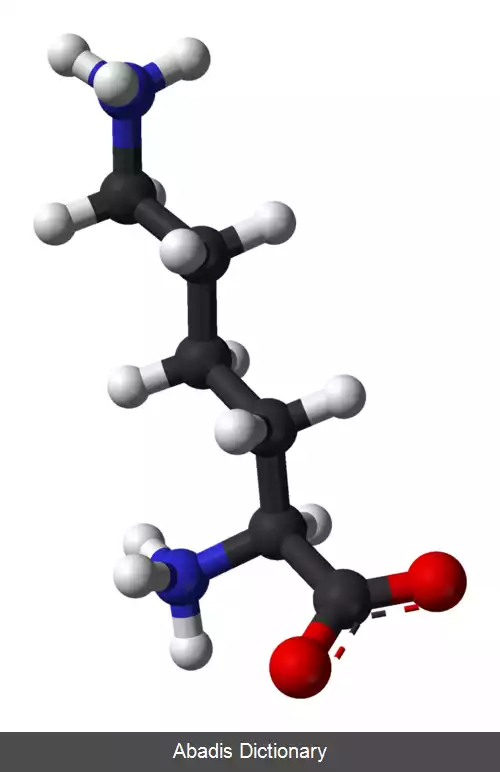
لیزین ( نماد: Lys یا K ) یکی از بیست آمینو اسید اصلی یاخته های زنده است. لیزین یک α - آمینو اسید است که در بیوسنتز پروتئین ها استفاده می شود و حاوی یک گروه α - آمینو ( که در شرایط بیولوژیکی پروتونیزه شده و به −NH3+ تبدیل می شود ) ، یک گروه α - کربوکسیلیک اسید ( که در شرایط بیولوژیکی پروتون از دست داده و به −COO− تبدیل می شود ) و یک زنجیر جانبی لیزیل ( CH2 ) 4NH2 ) ) است و به عنوان یک آمینو اسید آلیفاتیک، باردار در پی اچ فیزیولوژیک و قلیایی طبقه بندی می شود. لیزین توسط کدون های AAA و AAG کدگذاری می شود.
مانند تقریباً تمام اسیدهای آمینهٔ دیگر، α - کربن آن کایرال بوده و لیزین ممکن است به صورت دو انانتیومر ( ایزومر نوری ) L و D یا مخلوط راسمیک از هر دو انانتیومر وجود داشته باشد. تنها انانتیومر L - Lysine از نظر بیولوژیکی فعال بوده و α - کربن آن در پیکربندی S قرار دارد. بدن انسان نمی تواند لیزین را سنتز کند، بنابراین در انسان یک اسید آمینهٔ ضروری محسوب می شود و باید از غذا به دست آید. در موجوداتی که سنتز لیزین دارند، دو مسیر اصلی بیوسنتز هست که عبارت اند از مسیر diaminopimelate و مسیر α - aminoadipate که از آنزیم ها و سوبستراهای مختلف استفاده می کنند و در جانداران مختلف یافت می شوند. کاتابولیسم لیزین از طریق یکی از مسیرهای مختلف رخ می دهد، که شایع ترین مسیر saccharopine است.
لیزین چندین نقش را در انسان ایفا می کند، مهم ترین آن ها پروتئین زایی است، اما همچنین در ارتباط متقابل پلی پپتیدهای کلاژن، جذب مواد معدنی مغذی ضروری و تولید کارنیتین، که کلیدی در متابولیسم اسیدهای چرب است نقش دارد. لیزین اغلب در تغییرات هیستون دخالت دارد و در نتیجه، اپی ژنوم را متأثر می کند. گروه ε - آمین اغلب در پیوند هیدروژنی و به عنوان یک پایهٔ کلی در کاتالیز شرکت می کند.
گروه ε - آمونیوم ( NH3+ ) به کربن چهارم از α - کربن چسبیده است که آن خود به گروه کربوکسیل ( C=OOH ) متصل است. با توجه به اهمیت آن در چندین فرایند بیولوژیکی، نبودن لیزین می تواند منجر به بیماری های مختلفی از جمله نقص در مفاصل، اختلال در متابولیسم اسیدهای چرب، کم خونی و کمبود سیستمیک انرژی پروتئینی شود. در مقابل، تجمع بیش از حد لیزین، ناشی از کاتابولیسم ناکارآمد آن، می تواند به مشکلات شدید عصبی بیانجامد. لیزین نخستین بار توسط زیست شیمیدان آلمانی به نام فردیناند هاینریش ادموند درشل در سال ۱۸۸۹ از پروتئین کازئین موجود در شیر جدا شد. او آن را «لیزین» نامید. در سال ۱۹۰۲، شیمی دان آلمانی امیل فیشر و فریتز ویگرت، ساختار شیمیایی لیزین را با سنتز آن مشخص کردند.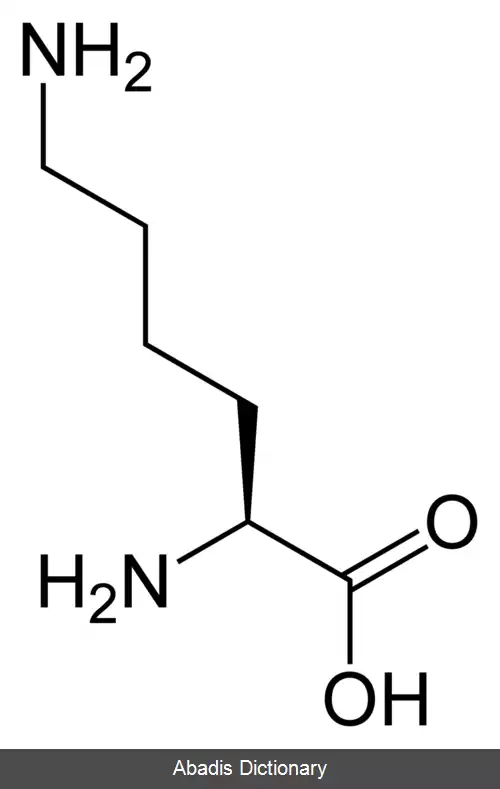
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفمانند تقریباً تمام اسیدهای آمینهٔ دیگر، α - کربن آن کایرال بوده و لیزین ممکن است به صورت دو انانتیومر ( ایزومر نوری ) L و D یا مخلوط راسمیک از هر دو انانتیومر وجود داشته باشد. تنها انانتیومر L - Lysine از نظر بیولوژیکی فعال بوده و α - کربن آن در پیکربندی S قرار دارد. بدن انسان نمی تواند لیزین را سنتز کند، بنابراین در انسان یک اسید آمینهٔ ضروری محسوب می شود و باید از غذا به دست آید. در موجوداتی که سنتز لیزین دارند، دو مسیر اصلی بیوسنتز هست که عبارت اند از مسیر diaminopimelate و مسیر α - aminoadipate که از آنزیم ها و سوبستراهای مختلف استفاده می کنند و در جانداران مختلف یافت می شوند. کاتابولیسم لیزین از طریق یکی از مسیرهای مختلف رخ می دهد، که شایع ترین مسیر saccharopine است.
لیزین چندین نقش را در انسان ایفا می کند، مهم ترین آن ها پروتئین زایی است، اما همچنین در ارتباط متقابل پلی پپتیدهای کلاژن، جذب مواد معدنی مغذی ضروری و تولید کارنیتین، که کلیدی در متابولیسم اسیدهای چرب است نقش دارد. لیزین اغلب در تغییرات هیستون دخالت دارد و در نتیجه، اپی ژنوم را متأثر می کند. گروه ε - آمین اغلب در پیوند هیدروژنی و به عنوان یک پایهٔ کلی در کاتالیز شرکت می کند.
گروه ε - آمونیوم ( NH3+ ) به کربن چهارم از α - کربن چسبیده است که آن خود به گروه کربوکسیل ( C=OOH ) متصل است. با توجه به اهمیت آن در چندین فرایند بیولوژیکی، نبودن لیزین می تواند منجر به بیماری های مختلفی از جمله نقص در مفاصل، اختلال در متابولیسم اسیدهای چرب، کم خونی و کمبود سیستمیک انرژی پروتئینی شود. در مقابل، تجمع بیش از حد لیزین، ناشی از کاتابولیسم ناکارآمد آن، می تواند به مشکلات شدید عصبی بیانجامد. لیزین نخستین بار توسط زیست شیمیدان آلمانی به نام فردیناند هاینریش ادموند درشل در سال ۱۸۸۹ از پروتئین کازئین موجود در شیر جدا شد. او آن را «لیزین» نامید. در سال ۱۹۰۲، شیمی دان آلمانی امیل فیشر و فریتز ویگرت، ساختار شیمیایی لیزین را با سنتز آن مشخص کردند.



wiki: لیزین
