الگو:Atomic radius
شعاع یونی ، یون r ، شعاع یک یون تک اتمی در ساختار بلوری یونی است. اگرچه نه اتم ها و نه یون ها مرزهای تیز ندارند، اما با آنها به گونه ای رفتار می شود که انگار کره های سختی با شعاع هایی هستند که مجموع شعاع های یونی کاتیون و آنیون فاصله بین یون های یک شبکه بلوری را نشان می دهد . شعاع یونی معمولاً در واحدهای پیکومتر ( pm ) یا آنگستروم ( Å ) با Å = 100 pm داده می شود. از مقادیر معمولی از 31 پیکومتر ( 0. 3 Å ) تا به بیش از200 پیکومتر ( 2Å ) متغیر است.
این مفهوم را می توان به یون های حل شده در محلول های مایع با در نظر گرفتن پوسته حلال سازی تعمیم داد.
بسته به بار الکتریکی یون، یونها ممکن است بزرگتر یا کوچکتر از اتم خنثی باشند. هنگامی که خصوصیت کووالانسی بیشتر پیوندها در AgCl و AgBr طول پیوند و در نتیجه شعاع یونی ظاهری Ag + را کاهش می دهد، اثری که در هالیدهای سدیم الکترومثبت تر و همچنین در فلوراید نقره که یون فلوراید در آن وجود دارد، وجود ندارد. نسبتا غیرقطبی است.
یک اتم برای تشکیل کاتیون الکترون خود را از دست می دهد، سایر الکترون ها بیشتر به سمت هسته جذب می شوند و شعاع یون کوچکتر می شود. به طور مشابه، هنگامی که یک الکترون به یک اتم اضافه می شود و یک آنیون تشکیل می دهد، الکترون اضافه شده اندازه ابر الکترونی را با دافعه بین الکترونیکی افزایش می دهد.
شعاع یونی یک ویژگی ثابت برای یک یون مشخص نیست، اما با عدد هماهنگی ، وضعیت اسپین و سایر پارامترها تغییر می کند. با این وجود، مقادیر شعاع یونی به اندازه کافی قابل انتقال هستند تا روندهای دوره ای را شناسایی کنند. مانند سایر انواع شعاع اتمی ، شعاع یونی با نزول یک گروه افزایش می یابد. اندازه یونی ( برای همان یون ) نیز با افزایش عدد هماهنگی افزایش می یابد و یک یون در حالت اسپین بالا بزرگتر از همان یون در حالت اسپین پایین خواهد بود. به طور کلی شعاع یونی با افزایش بار مثبت کاهش و با افزایش بار منفی افزایش می یابد.
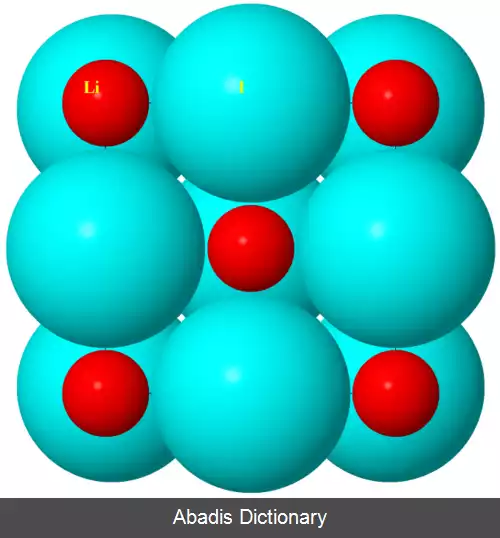
یک شعاع یونی "غیر عادی" در یک کریستال اغلب نشانه ای از ویژگی کووالانسی قابل توجه در پیوند است. هیچ پیوندی کاملاً یونی نیست، و برخی از ترکیبات ظاهراً "یونی"، به ویژه فلزات واسطه، خصوصیات کووالانسی دارند. این با پارامترهای سلول واحد برای هالیدهای سدیم و نقره در جدول نشان داده شده است. بر اساس فلورایدها، می توان گفت که Ag + بزرگتر از Na + است، اما بر اساس کلریدها و برمیدها، عکس این امر به نظر می رسد. [ ۱]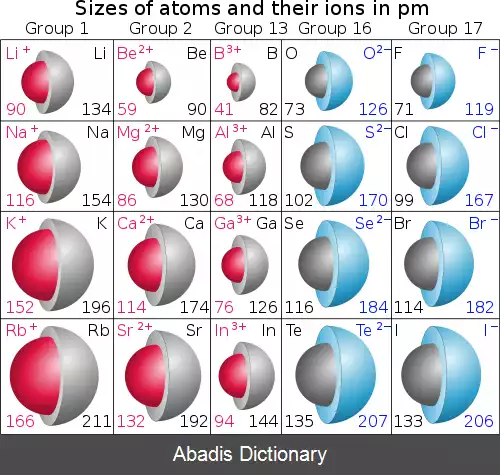
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفشعاع یونی ، یون r ، شعاع یک یون تک اتمی در ساختار بلوری یونی است. اگرچه نه اتم ها و نه یون ها مرزهای تیز ندارند، اما با آنها به گونه ای رفتار می شود که انگار کره های سختی با شعاع هایی هستند که مجموع شعاع های یونی کاتیون و آنیون فاصله بین یون های یک شبکه بلوری را نشان می دهد . شعاع یونی معمولاً در واحدهای پیکومتر ( pm ) یا آنگستروم ( Å ) با Å = 100 pm داده می شود. از مقادیر معمولی از 31 پیکومتر ( 0. 3 Å ) تا به بیش از200 پیکومتر ( 2Å ) متغیر است.
این مفهوم را می توان به یون های حل شده در محلول های مایع با در نظر گرفتن پوسته حلال سازی تعمیم داد.
بسته به بار الکتریکی یون، یونها ممکن است بزرگتر یا کوچکتر از اتم خنثی باشند. هنگامی که خصوصیت کووالانسی بیشتر پیوندها در AgCl و AgBr طول پیوند و در نتیجه شعاع یونی ظاهری Ag + را کاهش می دهد، اثری که در هالیدهای سدیم الکترومثبت تر و همچنین در فلوراید نقره که یون فلوراید در آن وجود دارد، وجود ندارد. نسبتا غیرقطبی است.
یک اتم برای تشکیل کاتیون الکترون خود را از دست می دهد، سایر الکترون ها بیشتر به سمت هسته جذب می شوند و شعاع یون کوچکتر می شود. به طور مشابه، هنگامی که یک الکترون به یک اتم اضافه می شود و یک آنیون تشکیل می دهد، الکترون اضافه شده اندازه ابر الکترونی را با دافعه بین الکترونیکی افزایش می دهد.
شعاع یونی یک ویژگی ثابت برای یک یون مشخص نیست، اما با عدد هماهنگی ، وضعیت اسپین و سایر پارامترها تغییر می کند. با این وجود، مقادیر شعاع یونی به اندازه کافی قابل انتقال هستند تا روندهای دوره ای را شناسایی کنند. مانند سایر انواع شعاع اتمی ، شعاع یونی با نزول یک گروه افزایش می یابد. اندازه یونی ( برای همان یون ) نیز با افزایش عدد هماهنگی افزایش می یابد و یک یون در حالت اسپین بالا بزرگتر از همان یون در حالت اسپین پایین خواهد بود. به طور کلی شعاع یونی با افزایش بار مثبت کاهش و با افزایش بار منفی افزایش می یابد.
یک شعاع یونی "غیر عادی" در یک کریستال اغلب نشانه ای از ویژگی کووالانسی قابل توجه در پیوند است. هیچ پیوندی کاملاً یونی نیست، و برخی از ترکیبات ظاهراً "یونی"، به ویژه فلزات واسطه، خصوصیات کووالانسی دارند. این با پارامترهای سلول واحد برای هالیدهای سدیم و نقره در جدول نشان داده شده است. بر اساس فلورایدها، می توان گفت که Ag + بزرگتر از Na + است، اما بر اساس کلریدها و برمیدها، عکس این امر به نظر می رسد. [ ۱]


wiki: شعاع یونی
