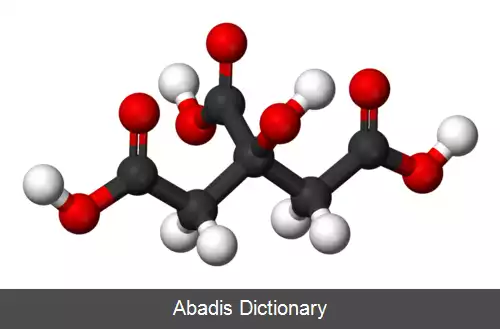
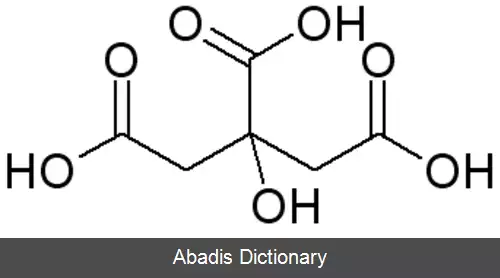
اسید سیتریک یا جوهر لیمو یکی از اسیدهای آلی است که هم در لیموترش و هم پرتقال وجود دارد. فرمول شیمیایی آن C6H8O7 می باشد؛ و نام آیوپاک آن 2 - Hydroxypropane - 1, 2, 3 - tricarboxylic acid است. کشف این اسید به جابر بن حیان نسبت داده می شود. [ ۴]
سالانه بیش از دو میلیون تن اسید سیتریک در جهان تولید می شود. از این ماده به طور گسترده ای به عنوان ترش کننده، طعم دهنده یا یک عامل کی لاته کننده استفاده می شود. [ ۵]
اسید سیتریک یک هیدروکسی اسید است. هیدروکسی اسیدها گروهی از اسیدهای کربوکسیلیک هستند که یک گروه عاملی هیدروکسیل به آن ها افزوده شده است.
اسید سیتریک یا جوهر لیمو یکی از اسیدهای آلی است که در لیموترش و پرتقال وجود دارد. یکی از عمده ترین کشورهای تولیدکننده آن کشور چین می باشد. یکی از ساده ترین روش هایی که برای تولید آن به کار می رود استفاده از قارچ آسپرژیلوس نایجر است.
تولید جهانی اسید سیتریک در سال ۲۰۱۸ بیش از ۲٬۰۰۰٬۰۰۰ تن بود. [ ۶] بیش از ۵۰٪ از این حجم در چین تولید شده است. بیش از ۵۰٪ به عنوان تنظیم کننده اسیدیته در نوشیدنی ها، حدود ۲۰٪ در سایر کاربردهای غذایی، ۲۰٪ برای مواد شوینده و ۱۰٪ برای موارد دیگر به غیر از مواد غذایی مانند مواد آرایشی، دارویی و در صنایع شیمیایی استفاده می شود. [ ۷]
در سال ۲۰۱۶ اندازه بازار جهانی اسید سیتریک ۲٫۵۰ میلیارد دلار بود. [ ۸]
این ماده می تواند در یک فرم بدون آب یا به عنوان یک مونوهیدرات وجود داشته باشد.
شکل بی آب کریستال از آب گرم به دست می آید، در حالی که مونوهیدرات زمانی ایجاد می شود که اسید سیتریک از آب سرد کریستال شود.
مونوهیدرات می تواند در حدود ۷۸ درجه سانتی گراد به شکل بی آب تبدیل شود. اسید سیتریک در اتانول مطلق ( بدون آب ) ( ۷۶ قسمت اسید سیتریک در هر ۱۰۰ قسمت اتانول ) در دمای ۱۵ درجه سانتیگراد حل می شود. با تخریب کربن دی اکسید در بالای ۱۷۵ درجه سانتیگراد تجزیه می شود. از سوی دیگر، pH محلول ۱ میلی متری این ماده حدود ۳٫۲ است. pH آب میوه های مرکباتی مانند پرتقال و لیمو بستگی به غلظت اسید سیتریک دارد، به طوری که برای غلظت اسیدی بالاتر بیشتر می شود و برعکس.
نمک این ماده را می توان با تنظیم دقیق pH قبل از کریستالیزاسیون ترکیب آماده کرد. به عنوان مثال، سدیم سیترات را ببینید:
یون سیترات با کمپلکس های فلزی تشکیل می شود. ثابت های پایدار برای تشکیل این مجتمع ها به دلیل اثرکلات بسیار زیاد است. در نتیجه، حتی با کاتدی فلز قلیایی تشکیل می دهد. با این حال، هنگامی که یک مجموعه کلات با تمام سه گروه کربوکسیلات تشکیل می شود، حلقه های کلات دارای ۷ و ۸ عضو هستند که عموماً از نظر ترمودینامیکی پایدارتر از حلقه های کوچکتر کلات است. اسید سیتریک را می توان در یک یا چند گروه کارکردی اسید کربوکسیلیک بر روی مولکول ( با استفاده از انواع مختلف الکل ها ) استرید کرد تا هر یک از انواع استرهای mono, di, tri و mixed را تشکیل دهند.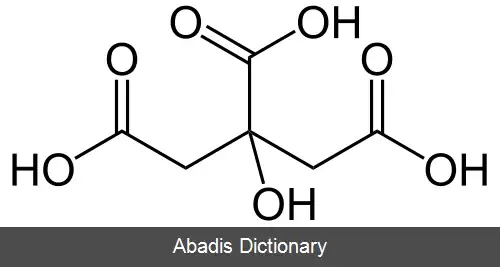


این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفسالانه بیش از دو میلیون تن اسید سیتریک در جهان تولید می شود. از این ماده به طور گسترده ای به عنوان ترش کننده، طعم دهنده یا یک عامل کی لاته کننده استفاده می شود. [ ۵]
اسید سیتریک یک هیدروکسی اسید است. هیدروکسی اسیدها گروهی از اسیدهای کربوکسیلیک هستند که یک گروه عاملی هیدروکسیل به آن ها افزوده شده است.
اسید سیتریک یا جوهر لیمو یکی از اسیدهای آلی است که در لیموترش و پرتقال وجود دارد. یکی از عمده ترین کشورهای تولیدکننده آن کشور چین می باشد. یکی از ساده ترین روش هایی که برای تولید آن به کار می رود استفاده از قارچ آسپرژیلوس نایجر است.
تولید جهانی اسید سیتریک در سال ۲۰۱۸ بیش از ۲٬۰۰۰٬۰۰۰ تن بود. [ ۶] بیش از ۵۰٪ از این حجم در چین تولید شده است. بیش از ۵۰٪ به عنوان تنظیم کننده اسیدیته در نوشیدنی ها، حدود ۲۰٪ در سایر کاربردهای غذایی، ۲۰٪ برای مواد شوینده و ۱۰٪ برای موارد دیگر به غیر از مواد غذایی مانند مواد آرایشی، دارویی و در صنایع شیمیایی استفاده می شود. [ ۷]
در سال ۲۰۱۶ اندازه بازار جهانی اسید سیتریک ۲٫۵۰ میلیارد دلار بود. [ ۸]
این ماده می تواند در یک فرم بدون آب یا به عنوان یک مونوهیدرات وجود داشته باشد.
شکل بی آب کریستال از آب گرم به دست می آید، در حالی که مونوهیدرات زمانی ایجاد می شود که اسید سیتریک از آب سرد کریستال شود.
مونوهیدرات می تواند در حدود ۷۸ درجه سانتی گراد به شکل بی آب تبدیل شود. اسید سیتریک در اتانول مطلق ( بدون آب ) ( ۷۶ قسمت اسید سیتریک در هر ۱۰۰ قسمت اتانول ) در دمای ۱۵ درجه سانتیگراد حل می شود. با تخریب کربن دی اکسید در بالای ۱۷۵ درجه سانتیگراد تجزیه می شود. از سوی دیگر، pH محلول ۱ میلی متری این ماده حدود ۳٫۲ است. pH آب میوه های مرکباتی مانند پرتقال و لیمو بستگی به غلظت اسید سیتریک دارد، به طوری که برای غلظت اسیدی بالاتر بیشتر می شود و برعکس.
نمک این ماده را می توان با تنظیم دقیق pH قبل از کریستالیزاسیون ترکیب آماده کرد. به عنوان مثال، سدیم سیترات را ببینید:
یون سیترات با کمپلکس های فلزی تشکیل می شود. ثابت های پایدار برای تشکیل این مجتمع ها به دلیل اثرکلات بسیار زیاد است. در نتیجه، حتی با کاتدی فلز قلیایی تشکیل می دهد. با این حال، هنگامی که یک مجموعه کلات با تمام سه گروه کربوکسیلات تشکیل می شود، حلقه های کلات دارای ۷ و ۸ عضو هستند که عموماً از نظر ترمودینامیکی پایدارتر از حلقه های کوچکتر کلات است. اسید سیتریک را می توان در یک یا چند گروه کارکردی اسید کربوکسیلیک بر روی مولکول ( با استفاده از انواع مختلف الکل ها ) استرید کرد تا هر یک از انواع استرهای mono, di, tri و mixed را تشکیل دهند.





wiki: سیتریک اسید
