ثابت تفکیک اسیدی یا ثابت اسیدی یا ثابت یونی شدن اسید ( به انگلیسی: acid dissociation constant یاacidity constant یا acid - ionization constant ) با نماد Ka معیاری است کمی از میزان قدرت یک اسید در محلول. ثابت تفکیک اسیدی، همان ثابت تعادل برای یک واکنش شیمیایی جداسازی در واکنش های اسیدی - بازی است. تعادل را می توان به صورت نمادین به شکل زیر نمایش داد:
که HA نماد عمومی اسید است و می تواند به صورت A− یا conjugate base و H+ یا یون هیدروژن یا پروتون از هم جدا شود. هنگامی می گوییم A− و H+ در HA در تعادل است که با گذر زمان غلظت آن ها تغییر نکند. رابطهٔ ثابت تفکیک اسیدی عبارت است از:
یکای و و همگی مول بر لیتر است. ( mol/L )
مطابق تعریف سوانت آرنیوس اسید ماده ای است که در محلول آبی از هم جدا می شود و یون هیدروژن H+ ( یک پروتون ) آزاد می کند. [ ۱]
ثابت تعادل در این گونه واکنش های جداسازی، ثابت تفکیک نام دارد. پروتون آزاد شده با یک مولکول آب وارد واکنش می شود تا یک هیدرونیوم ( یا اکسینیوم ) یون H۳O+ بدهد. بعدها آرنیوس پیشنهاد کرد که این جداسازی را با نام واکنش اسید - باز شناخته شود.
پس از آن برونستد و لری این نظریه را عمومی تر بیان کردند و آن را نوعی «واکنش داد و ستد پروتون» دانستند. [ ۲] [ ۳] [ ۴] برطبق مدل آنها اسید ماده ای ( آنیون، کاتیون یا مولکول ) است که بتواند صرف نظر از ماهیت حلال یک یون هیدروژن یا پروتون را به ماده ای دیگر بدهد.
به عبارت دیگر اسید برونستد، دهنده ی پروتون است.
اسید پروتون خود را از دست می دهد و باز مزدوج تولید می شود، پروتون به باز منتقل می شود و اسید مزدوج تولید می شود. در محلول آبی اسید HA، آب نقش یک باز را بازی می کند. باز مزدوج A− و اسید مزدوج یون هیدرونیوم است. تعریف برونستد و لری در دیگر محلول ها مانند دی متیل سولفکسید کاربردی است. حلال S به عنوان مادهٔ بازی عمل می کند، پروتون می پذیرد و اسید مزدوج SH+ را تشکیل می دهد.
در شیمی محلول ها، بسیار پرکاربرد است که از H+ به عنوان کوتاه شدهٔ یون هیدروژن محلول استفاده کنیم. در محلول های آبی H+ نشان دهندهٔ یک یون هیدرونیوم حل شده است تا یک پروتون. [ ۵] [ ۶]
• Albert, A. ( 1971 ) . The Determination of Ionization Constants: A Laboratory Manual. Chapman & Hall. ISBN 0412103001. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help ) ( Previous edition published as Ionization constants of acids and bases. London ( UK ) : Methuen. 1962. )
• Atkins, P. W. ( 2008 ) . Chemical Principles: The Quest for Insight ( 4th ed. ) . W. H. Freeman. ISBN 1 - 4292 - 0965 - 8. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help )
• Housecroft, C. E. ; Sharpe, A. G. ( 2008 ) . Inorganic Chemistry ( 3rd ed. ) . Prentice Hall. ISBN 978 - 0131755536. ( Non - aqueous solvents )
• Hulanicki, A. ( 1987 ) . Reactions of Acids and Bases in Analytical Chemistry. Horwood. ISBN 0853123306. ( translation editor: Mary R. Masson )
• Perrin, D. D. ( 1981 ) . pKa Prediction for Organic Acids and Bases. Chapman & Hall. ISBN 041222190X. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help )
• Reichardt, C. ( 2003 ) . Solvents and Solvent Effects in Organic Chemistry ( 3rd ed. ) . Wiley - VCH. ISBN 3 - 527 - 30618 - 8. Chapter 4: Solvent Effects on the Position of Homogeneous Chemical Equilibria.
• Skoog, D. A. ( 2004 ) . Fundamentals of Analytical Chemistry ( 8th ed. ) . Thomson Brooks/Cole. ISBN 0 - 03 - 035523 - 0. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help )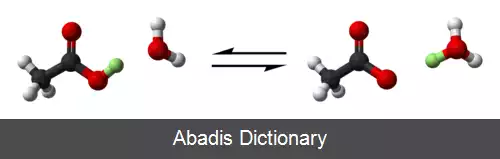
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفکه HA نماد عمومی اسید است و می تواند به صورت A− یا conjugate base و H+ یا یون هیدروژن یا پروتون از هم جدا شود. هنگامی می گوییم A− و H+ در HA در تعادل است که با گذر زمان غلظت آن ها تغییر نکند. رابطهٔ ثابت تفکیک اسیدی عبارت است از:
یکای و و همگی مول بر لیتر است. ( mol/L )
مطابق تعریف سوانت آرنیوس اسید ماده ای است که در محلول آبی از هم جدا می شود و یون هیدروژن H+ ( یک پروتون ) آزاد می کند. [ ۱]
ثابت تعادل در این گونه واکنش های جداسازی، ثابت تفکیک نام دارد. پروتون آزاد شده با یک مولکول آب وارد واکنش می شود تا یک هیدرونیوم ( یا اکسینیوم ) یون H۳O+ بدهد. بعدها آرنیوس پیشنهاد کرد که این جداسازی را با نام واکنش اسید - باز شناخته شود.
پس از آن برونستد و لری این نظریه را عمومی تر بیان کردند و آن را نوعی «واکنش داد و ستد پروتون» دانستند. [ ۲] [ ۳] [ ۴] برطبق مدل آنها اسید ماده ای ( آنیون، کاتیون یا مولکول ) است که بتواند صرف نظر از ماهیت حلال یک یون هیدروژن یا پروتون را به ماده ای دیگر بدهد.
به عبارت دیگر اسید برونستد، دهنده ی پروتون است.
اسید پروتون خود را از دست می دهد و باز مزدوج تولید می شود، پروتون به باز منتقل می شود و اسید مزدوج تولید می شود. در محلول آبی اسید HA، آب نقش یک باز را بازی می کند. باز مزدوج A− و اسید مزدوج یون هیدرونیوم است. تعریف برونستد و لری در دیگر محلول ها مانند دی متیل سولفکسید کاربردی است. حلال S به عنوان مادهٔ بازی عمل می کند، پروتون می پذیرد و اسید مزدوج SH+ را تشکیل می دهد.
در شیمی محلول ها، بسیار پرکاربرد است که از H+ به عنوان کوتاه شدهٔ یون هیدروژن محلول استفاده کنیم. در محلول های آبی H+ نشان دهندهٔ یک یون هیدرونیوم حل شده است تا یک پروتون. [ ۵] [ ۶]
• Albert, A. ( 1971 ) . The Determination of Ionization Constants: A Laboratory Manual. Chapman & Hall. ISBN 0412103001. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help ) ( Previous edition published as Ionization constants of acids and bases. London ( UK ) : Methuen. 1962. )
• Atkins, P. W. ( 2008 ) . Chemical Principles: The Quest for Insight ( 4th ed. ) . W. H. Freeman. ISBN 1 - 4292 - 0965 - 8. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help )
• Housecroft, C. E. ; Sharpe, A. G. ( 2008 ) . Inorganic Chemistry ( 3rd ed. ) . Prentice Hall. ISBN 978 - 0131755536. ( Non - aqueous solvents )
• Hulanicki, A. ( 1987 ) . Reactions of Acids and Bases in Analytical Chemistry. Horwood. ISBN 0853123306. ( translation editor: Mary R. Masson )
• Perrin, D. D. ( 1981 ) . pKa Prediction for Organic Acids and Bases. Chapman & Hall. ISBN 041222190X. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help )
• Reichardt, C. ( 2003 ) . Solvents and Solvent Effects in Organic Chemistry ( 3rd ed. ) . Wiley - VCH. ISBN 3 - 527 - 30618 - 8. Chapter 4: Solvent Effects on the Position of Homogeneous Chemical Equilibria.
• Skoog, D. A. ( 2004 ) . Fundamentals of Analytical Chemistry ( 8th ed. ) . Thomson Brooks/Cole. ISBN 0 - 03 - 035523 - 0. {{cite book}}: Unknown parameter | coauthors= ignored ( | author= suggested ) ( help )

wiki: ثابت تفکیک اسیدی
