دی نیتروژن تری اکسید ( به انگلیسی: Dinitrogen trioxide ) با فرمول شیمیایی N۲O۳ یک ترکیب شیمیایی است که جرم مولی آن 76. 01 g/mol می باشد. شکل ظاهری این ترکیب، مایع آبی است.
این ماده یک ترکیب مولکولی است و دارای توالی اتمها به شکل ONNO2 می باشد. در این مولکول هر دو اتم نیتروژن دارای سه قلمروی الکترونی هستند و این بدان معنا است که از اوربیتال های هیبریدی sp2 برای ایجاد پیوند استفاده کرده اند. از آن جا که اتم نیتروژن حامل یک اکسیژن، دارای جفت الکترون ناپیوندی است؛ تقارن ساختار مولکول به هم خورده است[ ۱] . پیوند بین دو اتم نیتروژن به شکل پیوند یگانه است ولی پیوند بین اتم های نیتروژن و اکسیژن بر دو نوع است. گروه NO2 دارای مرتبهٔ پیوند معادل 1٫5 و گروه NO دارای مرتبهٔ پیوند 2 استه. این واقعیت را می توان با دو ساختار رزونانسی برای این مولکول به نمایش گذاشت.
این مولکول به دلیل عدم تقارن ساختار، خصلت قطبیت دارد که البته به دلیل نزدیک بودن الکترونگاتیوی اتمهای درگیر پیوند، چندان بالا نیست. همین قطبیت کم باعث می شود در آب و اتر حل شود. نقطهٔ ذوب و جوش این ماده پایین است؛ زیرا نیروی قدرتمندی بین مولکول هایش برقرار نیست. این ماده در دمای اتاق، گازی بی رنگ است.
همان طور که ساختار مولکول این ماده مشخص می کند؛ می توان دی نیتروژن تری اکسید را از واکنش نیتروژن منواکسید و نیتروژن دی اکسید تهیه نمود. طی این واکنش بین اتم نیتروژن مولکول هر یک از مواد اولیه یک پیوند کووالانسی شکل گرفته و مولکول های محصول تشکیل می شوند[ ۲] : ON+NO2→ON - NO2
این ماده همانند بسیاری از اکسیدهای نافلزی خصلت اسیدی دارد؛ به گونه ای که با آب واکنش داده و نیترو اسید ( نیتروس اسید ) را سنتز می کند: N2O3+H2O→2HNO2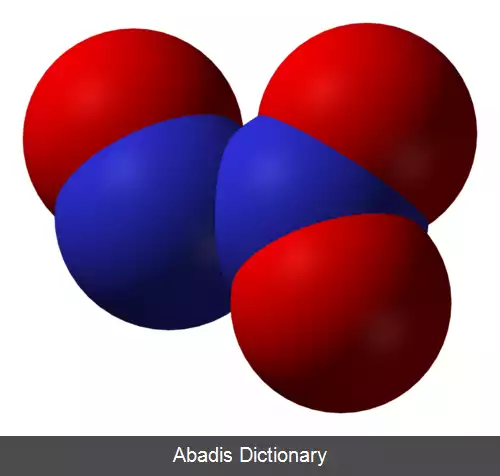
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاین ماده یک ترکیب مولکولی است و دارای توالی اتمها به شکل ONNO2 می باشد. در این مولکول هر دو اتم نیتروژن دارای سه قلمروی الکترونی هستند و این بدان معنا است که از اوربیتال های هیبریدی sp2 برای ایجاد پیوند استفاده کرده اند. از آن جا که اتم نیتروژن حامل یک اکسیژن، دارای جفت الکترون ناپیوندی است؛ تقارن ساختار مولکول به هم خورده است[ ۱] . پیوند بین دو اتم نیتروژن به شکل پیوند یگانه است ولی پیوند بین اتم های نیتروژن و اکسیژن بر دو نوع است. گروه NO2 دارای مرتبهٔ پیوند معادل 1٫5 و گروه NO دارای مرتبهٔ پیوند 2 استه. این واقعیت را می توان با دو ساختار رزونانسی برای این مولکول به نمایش گذاشت.
این مولکول به دلیل عدم تقارن ساختار، خصلت قطبیت دارد که البته به دلیل نزدیک بودن الکترونگاتیوی اتمهای درگیر پیوند، چندان بالا نیست. همین قطبیت کم باعث می شود در آب و اتر حل شود. نقطهٔ ذوب و جوش این ماده پایین است؛ زیرا نیروی قدرتمندی بین مولکول هایش برقرار نیست. این ماده در دمای اتاق، گازی بی رنگ است.
همان طور که ساختار مولکول این ماده مشخص می کند؛ می توان دی نیتروژن تری اکسید را از واکنش نیتروژن منواکسید و نیتروژن دی اکسید تهیه نمود. طی این واکنش بین اتم نیتروژن مولکول هر یک از مواد اولیه یک پیوند کووالانسی شکل گرفته و مولکول های محصول تشکیل می شوند[ ۲] : ON+NO2→ON - NO2
این ماده همانند بسیاری از اکسیدهای نافلزی خصلت اسیدی دارد؛ به گونه ای که با آب واکنش داده و نیترو اسید ( نیتروس اسید ) را سنتز می کند: N2O3+H2O→2HNO2


wiki: دی نیتروژن تری اکسید
