تیتراسیون اسید - باز ( به انگلیسی: Acid–base titration ) به معنی تعیین میزان غلظت یک اسید یا باز از راه خنثی سازی آن با کمک یک باز یا اسید دیگر با غلظت معلوم است. این روش به بررسی کمّی غلظت یک محلول اسید یا باز ناشناخته کمک می کند. در این روش باید از واکنش خنثی سازی میان اسیدها و بازها و دانش آنکه چگونه این مواد با ترکیب معلوم، با هم واکنش می دهند بهره برد.
همچنین تیتراسیون اسید - باز در پیدا کردن درصد خلوص مواد شیمیایی کاربرد دارند.
ابزارهای کلیدی در این فرایند عبارتند از:
• بورت
• صفحهٔ زمینهٔ سفید ( کاشی سفید ) که در آن تغییر رنگ محلول نمایان باشد.
• پیپت
• شناساگر پی اچ محلول ( مادهٔ شاخص بسته به محلول های گوناگون تفاوت می کند )
• ارلن یا یک ظرف مخروطی دیگر
• مادهٔ تیترکننده ( به انگلیسی: Titrant یا titrator ) ( یک محلول استاندارد با غلظت معلوم، برای نمونه محلول آبی سدیم کربنات )
• مادهٔ تیتر شونده ( به انگلیسی: titrand ) ( محلولی با غلظت نامعلوم )
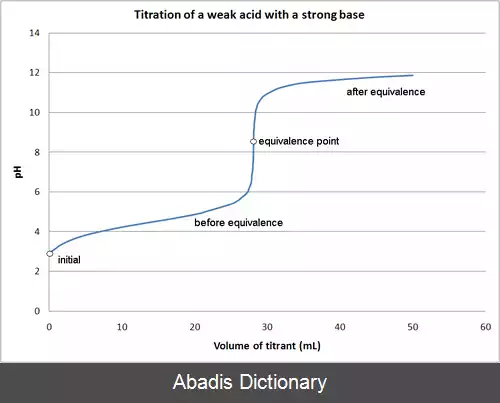
pH یک محلول اسید ضعیف که در حال تیتر شدن با یک باز قوی است، در طول فرایند مرتب تغییر می کند. این تغییرها را می توان در چند گام دسته بندی کرد:[ ۱]
• pH نخستین
• pH پیش از نقطهٔ تعادل
• pH در نقطهٔ تعادل
• pH پس از نقطهٔ تعادل
۱. pH نخستین در یک اسید ضعیف محلول در آب را می توان با کمک رابطهٔ زیر برآورد کرد:
که در آن Ka ثابت جداسازی و F غلظت اسید است.
۲. pH پیش از رسیدن به نقطهٔ تعادل به مقدار اسید ضعیف باقی مانده و مقدار باز مزدوج ایجاد شده بستگی دارد. pH را می توان به کمک رابطهٔ زیر بدست آورد[ ۲] ( نگاه کنید به معادلهٔ Henderson - Hasselbalch ) :
که در آن:
• pKa قرینهٔ لگاریتم ثابت جداسازی اسیدی برای اسید ضعیف است.
• nOH - added تعداد مول های باز قوی افزوده شده است.
• nHA initial تعداد مول های اسید ضعیف در آغاز است.
هرگاه n O H − a d d e d = n H A i n i t i a l − n O H − a d d e d باشد، نسبت به سمت یک می رود و لگاریتم به صفر نزدیک می شود در نتیجه pKa و pH برابر خواهند بود.
۳. در نقطهٔ تعادل اسید ضعیف مصرف می شود و به باز مزدوج ضعیف خود تبدیل می شود. در این هنگام pH بیش از ۷ خواهد بود و به کمک معادله ای برگرفته از رابطه های زیر، می توان آن را بدست آورد:
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفهمچنین تیتراسیون اسید - باز در پیدا کردن درصد خلوص مواد شیمیایی کاربرد دارند.
ابزارهای کلیدی در این فرایند عبارتند از:
• بورت
• صفحهٔ زمینهٔ سفید ( کاشی سفید ) که در آن تغییر رنگ محلول نمایان باشد.
• پیپت
• شناساگر پی اچ محلول ( مادهٔ شاخص بسته به محلول های گوناگون تفاوت می کند )
• ارلن یا یک ظرف مخروطی دیگر
• مادهٔ تیترکننده ( به انگلیسی: Titrant یا titrator ) ( یک محلول استاندارد با غلظت معلوم، برای نمونه محلول آبی سدیم کربنات )
• مادهٔ تیتر شونده ( به انگلیسی: titrand ) ( محلولی با غلظت نامعلوم )
pH یک محلول اسید ضعیف که در حال تیتر شدن با یک باز قوی است، در طول فرایند مرتب تغییر می کند. این تغییرها را می توان در چند گام دسته بندی کرد:[ ۱]
• pH نخستین
• pH پیش از نقطهٔ تعادل
• pH در نقطهٔ تعادل
• pH پس از نقطهٔ تعادل
۱. pH نخستین در یک اسید ضعیف محلول در آب را می توان با کمک رابطهٔ زیر برآورد کرد:
که در آن Ka ثابت جداسازی و F غلظت اسید است.
۲. pH پیش از رسیدن به نقطهٔ تعادل به مقدار اسید ضعیف باقی مانده و مقدار باز مزدوج ایجاد شده بستگی دارد. pH را می توان به کمک رابطهٔ زیر بدست آورد[ ۲] ( نگاه کنید به معادلهٔ Henderson - Hasselbalch ) :
که در آن:
• pKa قرینهٔ لگاریتم ثابت جداسازی اسیدی برای اسید ضعیف است.
• nOH - added تعداد مول های باز قوی افزوده شده است.
• nHA initial تعداد مول های اسید ضعیف در آغاز است.
هرگاه n O H − a d d e d = n H A i n i t i a l − n O H − a d d e d باشد، نسبت به سمت یک می رود و لگاریتم به صفر نزدیک می شود در نتیجه pKa و pH برابر خواهند بود.
۳. در نقطهٔ تعادل اسید ضعیف مصرف می شود و به باز مزدوج ضعیف خود تبدیل می شود. در این هنگام pH بیش از ۷ خواهد بود و به کمک معادله ای برگرفته از رابطه های زیر، می توان آن را بدست آورد:


wiki: تیتراسیون اسید باز
