کربن دی سولفید ( به انگلیسی: Carbon disulfide ) یک ترکیب معدنی با فرمول CS2. ترکیب مشابه آن کربونیل سولفید نام دارد. [ ۱]
دی سولفید کربن دارای یک اتم کربن و دو اتم گوگرد در کناره های آن است. پیوندهای بین اتم کربن و اتم های گوگرد کووالانسی و دوتایی هستند ، بنابراین بسیار قوی هستند. مولکول CS2 این یک ساختار خطی و متقارن است.
نامگذاری
1 ) دی سولفید کربن
2 ) بی سولفید کربن
3 ) انیدرید دیتیوکربن
مایع بی رنگ تا مایل به زرد
76. 15 گرم در مول
منفی 10. 8 درجه سانتی گراد
46. 0 درجه سانتیگراد
( روش جام بسته ) .
منفی سی درجه سانتیگراد
90 درجه سانتیگراد
مایع = 1. 26 گرم در سانتی متر3 در دمای 20 درجه سانتیگراد
بخار = 2. 67 برابر هوا.
بخارات آن بیش از دو برابر هوا سنگین تر و مایع از آب سنگین تر است.
279 میلی متر جیوه در 25 درجه سانتیگراد این یک فشار بخار بالا است
CS2 در دمای اتاق به راحتی تبخیر می شود زیرا نقطه جوش آن بسیار کم و فشار بخار آن بسیار زیاد است.
دی سولفید کربن بسیار اشتعال پذیر است. بخارات آن حتی با حرارت یک لامپ برقی به راحتی مشتعل می شوند. این بدان معنی است که بسیار سریع با اکسیژن واکنش نشان می دهد:
CS2 + 3 درجه2 → شرکت2 + 2 بنابراین2
این واقعیت که در دمای اتاق فشار بخار بالایی دارد ، قرار گرفتن در مجاورت شعله را خطرناک می کند.
هنگامی که گرم می شود تا تجزیه شود ، می تواند به راحتی منفجر شود و گازهای سمی اکسید گوگرد منتشر می کند. بالای 90 درجه سانتیگراد خود به خود شعله ور می شود.
در صورت نگهداری طولانی مدت تجزیه می شود. به مس و آلیاژهای آن حمله می کند. همچنین با برخی پلاستیک ها ، لاستیک ها و پوشش ها واکنش نشان می دهد.
تحت شرایط خاص با آب واکنش می دهد ، تشکیل کربنیل سولفید OCS ، دی اکسید کربن CO2 و دی سولفید هیدروژن H2S:
CS2 + H2O → OCS + H2S
CS2 + 2 ساعت2O → CO2 + 2 ساعت2S
با الکلها ( ROH ) در محیط قلیایی ، گزانتاتها ( RO - CS - SNa ) تشکیل می شود:
CS2 + ROH + NaOH → H2O + RO - C ( = S ) –SNa
دی سولفید کربن به صورت تجاری توسط واکنش گوگرد با کربن تهیه می شود. این فرآیند در دمای 750 - 900 درجه سانتیگراد انجام می شود.
C + 2 S → CS2
به جای زغال سنگ ، از متان یا گاز طبیعی نیز می توان استفاده کرد و حتی از اتان ، پروپان و پروپیلن نیز استفاده شده است که در این حالت واکنش در دمای 400 - 700 درجه سانتیگراد با عملکرد بالا اتفاق می افتد.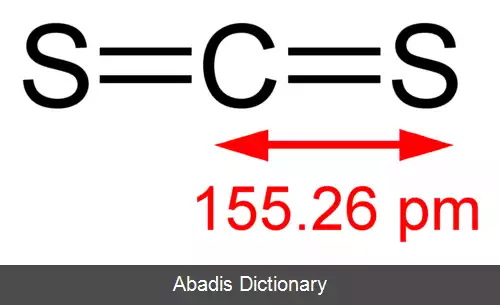
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدی سولفید کربن دارای یک اتم کربن و دو اتم گوگرد در کناره های آن است. پیوندهای بین اتم کربن و اتم های گوگرد کووالانسی و دوتایی هستند ، بنابراین بسیار قوی هستند. مولکول CS2 این یک ساختار خطی و متقارن است.
نامگذاری
1 ) دی سولفید کربن
2 ) بی سولفید کربن
3 ) انیدرید دیتیوکربن
مایع بی رنگ تا مایل به زرد
76. 15 گرم در مول
منفی 10. 8 درجه سانتی گراد
46. 0 درجه سانتیگراد
( روش جام بسته ) .
منفی سی درجه سانتیگراد
90 درجه سانتیگراد
مایع = 1. 26 گرم در سانتی متر3 در دمای 20 درجه سانتیگراد
بخار = 2. 67 برابر هوا.
بخارات آن بیش از دو برابر هوا سنگین تر و مایع از آب سنگین تر است.
279 میلی متر جیوه در 25 درجه سانتیگراد این یک فشار بخار بالا است
CS2 در دمای اتاق به راحتی تبخیر می شود زیرا نقطه جوش آن بسیار کم و فشار بخار آن بسیار زیاد است.
دی سولفید کربن بسیار اشتعال پذیر است. بخارات آن حتی با حرارت یک لامپ برقی به راحتی مشتعل می شوند. این بدان معنی است که بسیار سریع با اکسیژن واکنش نشان می دهد:
CS2 + 3 درجه2 → شرکت2 + 2 بنابراین2
این واقعیت که در دمای اتاق فشار بخار بالایی دارد ، قرار گرفتن در مجاورت شعله را خطرناک می کند.
هنگامی که گرم می شود تا تجزیه شود ، می تواند به راحتی منفجر شود و گازهای سمی اکسید گوگرد منتشر می کند. بالای 90 درجه سانتیگراد خود به خود شعله ور می شود.
در صورت نگهداری طولانی مدت تجزیه می شود. به مس و آلیاژهای آن حمله می کند. همچنین با برخی پلاستیک ها ، لاستیک ها و پوشش ها واکنش نشان می دهد.
تحت شرایط خاص با آب واکنش می دهد ، تشکیل کربنیل سولفید OCS ، دی اکسید کربن CO2 و دی سولفید هیدروژن H2S:
CS2 + H2O → OCS + H2S
CS2 + 2 ساعت2O → CO2 + 2 ساعت2S
با الکلها ( ROH ) در محیط قلیایی ، گزانتاتها ( RO - CS - SNa ) تشکیل می شود:
CS2 + ROH + NaOH → H2O + RO - C ( = S ) –SNa
دی سولفید کربن به صورت تجاری توسط واکنش گوگرد با کربن تهیه می شود. این فرآیند در دمای 750 - 900 درجه سانتیگراد انجام می شود.
C + 2 S → CS2
به جای زغال سنگ ، از متان یا گاز طبیعی نیز می توان استفاده کرد و حتی از اتان ، پروپان و پروپیلن نیز استفاده شده است که در این حالت واکنش در دمای 400 - 700 درجه سانتیگراد با عملکرد بالا اتفاق می افتد.


wiki: کربن دی سولفید
