نیتروس اسید یا نیترو اسید ( به انگلیسی: Nitrous acid ) با فرمول شیمیایی HNO۲ یک ترکیب شیمیایی با شناسه پاب کم ۲۴۵۲۹ است. که جرم مولی آن ۴۷٫۰۱۳ g/mol می باشد. شکل ظاهری این ترکیب، محلول آبی کمرنگ است. این ماده دارای خواص اسیدی است[ ۱] . هم چنین می تواند در واکنش های اکسایش و کاهش نیز شرکت نماید.
در نیترو اسید، توالی اتمها به شکل HONO است و ساختار پیوندی آن به صورت H - O - N=O می باشد. نیتروژن دارای هیبریداسیون sp2 است و اتم های اکسیژن از هیبریداسیون sp3 استفاده می کنند[ ۲] . چرخش حول پیوند H - O در این مولکول موجب می شود صورت بندیهای مختلفی دیده شود که فرم ترانس از فرم سیس پایدارتر می باشد ( به دلیل دافعهٔ کمتر ابر الکترونی پیوندهای H - O و N=O ) . به دلیل اختلاف الکترونگاتیوی بین اتم های پیوندی در این مولکول، و نیز به دلیل ساختار نامتقارن، مولکول نیترو اسید یک مولکول قطبی به شمار می آید.
نیترو اسید دارای مولکولهای قطبی است؛ بنابراین نیروی بین این مولکول ها از جنس جاذبه های دوقطبی - دوقطبی می باشد. از طرفی با توجه به ساختار مولکول که توالی H - O - N در آن دیده می شود؛ اتم هیدروژن در مولکول نیترو اسید دارای کمبود الکترون ( اندکی بار مثبت ) است و می تواند با اکسیژنِ متصل به نیتروژن مولکول دیگر، پیوند هیدروژنی برقرار نماید. با توجه به موارد گفته شده، نیترو اسید به خوبی در آب و سایر حلالهای قطبی دیگر ( با خاصیت یونیزه کنندگی بالا=ثابت دی الکتریک بالا ) حل می شود.
نیترو اسید یک اسید ضعیف است و می تواند با از دست دادن یون هیدروژن ( =پروتون ) به یون نیتریت تبدیل شود:
HNO2→H++NO2 -
بنابراین محلول نیترو اسید دارای pH ( پی اچ ) کم تر از 7 است.
عدد اکسایش نیترژن در این ماده 3+ است؛ پس می تواند تا 5+ بالا رود و تا 3 - پایین بیاید؛ بنابراین می توان نیترو اسید را به نیتریک اسید اکسید کرد یا آن را به مواد مختلف احیا نمود. چند نمونه از واکنش های مختلف را در زیر می بینید:
2HNO2+1O2→2HNO3
HNO2+ArNH2+H+→ArN2++2H2O
یکی از رایج ترین روش های تهیه ( سنتز ) این ماده، حل کردن دی نیتروژن تری اکسید ( نیتروژن ( III ) اکسید ) در آب است:
N2O3+H2O→2HNO2
NaNo2+ HCl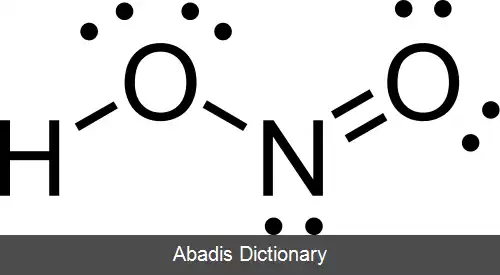
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر نیترو اسید، توالی اتمها به شکل HONO است و ساختار پیوندی آن به صورت H - O - N=O می باشد. نیتروژن دارای هیبریداسیون sp2 است و اتم های اکسیژن از هیبریداسیون sp3 استفاده می کنند[ ۲] . چرخش حول پیوند H - O در این مولکول موجب می شود صورت بندیهای مختلفی دیده شود که فرم ترانس از فرم سیس پایدارتر می باشد ( به دلیل دافعهٔ کمتر ابر الکترونی پیوندهای H - O و N=O ) . به دلیل اختلاف الکترونگاتیوی بین اتم های پیوندی در این مولکول، و نیز به دلیل ساختار نامتقارن، مولکول نیترو اسید یک مولکول قطبی به شمار می آید.
نیترو اسید دارای مولکولهای قطبی است؛ بنابراین نیروی بین این مولکول ها از جنس جاذبه های دوقطبی - دوقطبی می باشد. از طرفی با توجه به ساختار مولکول که توالی H - O - N در آن دیده می شود؛ اتم هیدروژن در مولکول نیترو اسید دارای کمبود الکترون ( اندکی بار مثبت ) است و می تواند با اکسیژنِ متصل به نیتروژن مولکول دیگر، پیوند هیدروژنی برقرار نماید. با توجه به موارد گفته شده، نیترو اسید به خوبی در آب و سایر حلالهای قطبی دیگر ( با خاصیت یونیزه کنندگی بالا=ثابت دی الکتریک بالا ) حل می شود.
نیترو اسید یک اسید ضعیف است و می تواند با از دست دادن یون هیدروژن ( =پروتون ) به یون نیتریت تبدیل شود:
HNO2→H++NO2 -
بنابراین محلول نیترو اسید دارای pH ( پی اچ ) کم تر از 7 است.
عدد اکسایش نیترژن در این ماده 3+ است؛ پس می تواند تا 5+ بالا رود و تا 3 - پایین بیاید؛ بنابراین می توان نیترو اسید را به نیتریک اسید اکسید کرد یا آن را به مواد مختلف احیا نمود. چند نمونه از واکنش های مختلف را در زیر می بینید:
2HNO2+1O2→2HNO3
HNO2+ArNH2+H+→ArN2++2H2O
یکی از رایج ترین روش های تهیه ( سنتز ) این ماده، حل کردن دی نیتروژن تری اکسید ( نیتروژن ( III ) اکسید ) در آب است:
N2O3+H2O→2HNO2
NaNo2+ HCl

wiki: نیترو اسید
