فرهنگ فارسی
کوچکترین جزو یک جسم مرکب ذره . توضیح کوچکترین جزو ماده بحالت آزاد است که خواص خود را از دست نداده . ملکول بسیار بسیار کوچک است و با قوی ترین میکروسکپها هم دیده نمیشود . برای تصور اندازه آن گوییم مثلا یک سانتیمتر مکعب اکسیژن در شرایط معمولی در حدود ... ۳٠ ۱٠ مولکول اکسیژن دارد.
فرهنگ معین
فرهنگ عمید
فرهنگستان زبان و ادب
دانشنامه عمومی
مولکول[ ۱] ( به فرانسوی: molécule ) کوچک ترین واحدی از یک ماده است که از دو یا چند اتم که با استفاده از نیروی حاصل از پیوند شیمیایی به یکدیگر متصل شده و کنار هم قرار گرفته اند تشکیل شده است. یک مولکول می تواند جورهسته باشد یعنی فقط از اتم های یک نوع عنصر شیمیایی تشکیل شده باشد مانند اتم های مولکول اکسیژن ( O۲ ) ؛ یا می تواند ناجورهسته باشد یعنی عناصر تشکیل دهنده آن بیشتر از یک نوع باشد مانند مولکول آب ( H۲O ) که از دو عنصر هیدروژن و یک عنصر اکسیژن تشکیل شده است.
نسبت اتم ها در یک مولکول خاص همیشه ثابت است یا به عبارتی دیگر فرمول مولکولی آن قابلیت ساده شدن ندارد. برای مثال در مولکول آب نسبت اتم های هیدروژن به اکسیژن همیشه ۲ است. تعداد اتم های موجود در یک مولکول به وسیله فرمول شیمیایی آن نشان داده می شود. البته باید توجه داشت که فرمول شیمیایی به تنهایی نشان دهنده ویژگی های ماده نیست. ممکن است دو ماده فرمول شیمیایی یکسانی داشته باشند، اما ویژگی های آن ها کاملاً متفاوت باشد. برای مثال اتانول و دی متیل اتر فرمول شیمیایی یکسان اما خواص شیمیایی متفاوت دارند که به این مواد ایزومر گفته می شود.
یک مولکول، مجموعه ای از اتم های یک مادهٔ مشخص دارای فرمول شیمیایی است. کلمهٔ مولکول از زبان لاتین گرفته شده و به معنی تودهٔ کوچکی از مواد می باشد. برای مثال مولکول متان ( CH4 ) از یک اتم کربن و چهار اتم هیدروژن تشکیل شده است یا یک مولکول آب ( H2O ) از یک اتم اکسیژن و دو اتم هیدروژن تشکیل شده است. یک مولکول ذره ای خیلی کوچکی است که دارای قابلیت حرکت و مستعد دادن واکنش شیمیایی با مواد دیگر است، در حالی که اتم از ذرات کوچک ثابت تری تشکیل شده و جابجایی آنها نیازمند انرژی بسیار زیادی است که برای انجام واکنش های هسته ای ضروری است.
مولکول های یک ماده در حال جنبش و حرکت دایمی هستند. این جنبش مولکول ها حرکت براونی نام دارد که برای اولین بار توسط روبرت براون در سال ۱۸۲۱میلادی کشف شده است. وقتی ماده به شکل گاز است مولکول ها دارای جنبش بسیار زیاد هستند و فضای بین مولکولها زیاد است. در حالت مایع فضای بین مولکولی کمتر و جنبش مولکول ها نیز کمتر است. در حالت جامد مولکول ها به صورت منظم چیده شده اند و دارای چرخش به دور یک فضای مشخص هستند. دمای یک ماده نشانگر میزان جنبش مولکول های آن ماده است.
نیروی واندروالسی نیروی ضعیفی ست که عامل جاذبه بین مولکول هاست.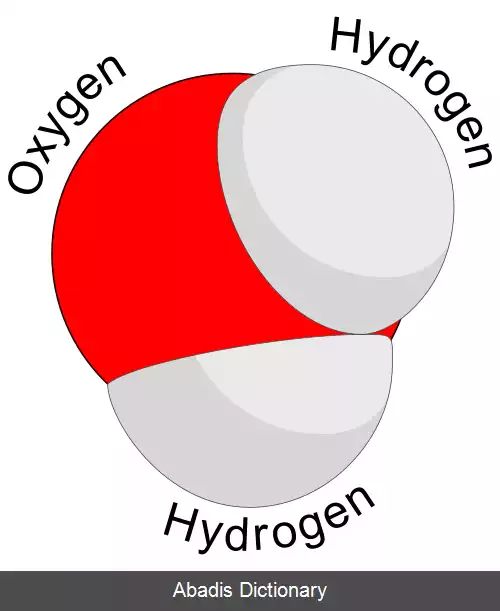
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفنسبت اتم ها در یک مولکول خاص همیشه ثابت است یا به عبارتی دیگر فرمول مولکولی آن قابلیت ساده شدن ندارد. برای مثال در مولکول آب نسبت اتم های هیدروژن به اکسیژن همیشه ۲ است. تعداد اتم های موجود در یک مولکول به وسیله فرمول شیمیایی آن نشان داده می شود. البته باید توجه داشت که فرمول شیمیایی به تنهایی نشان دهنده ویژگی های ماده نیست. ممکن است دو ماده فرمول شیمیایی یکسانی داشته باشند، اما ویژگی های آن ها کاملاً متفاوت باشد. برای مثال اتانول و دی متیل اتر فرمول شیمیایی یکسان اما خواص شیمیایی متفاوت دارند که به این مواد ایزومر گفته می شود.
یک مولکول، مجموعه ای از اتم های یک مادهٔ مشخص دارای فرمول شیمیایی است. کلمهٔ مولکول از زبان لاتین گرفته شده و به معنی تودهٔ کوچکی از مواد می باشد. برای مثال مولکول متان ( CH4 ) از یک اتم کربن و چهار اتم هیدروژن تشکیل شده است یا یک مولکول آب ( H2O ) از یک اتم اکسیژن و دو اتم هیدروژن تشکیل شده است. یک مولکول ذره ای خیلی کوچکی است که دارای قابلیت حرکت و مستعد دادن واکنش شیمیایی با مواد دیگر است، در حالی که اتم از ذرات کوچک ثابت تری تشکیل شده و جابجایی آنها نیازمند انرژی بسیار زیادی است که برای انجام واکنش های هسته ای ضروری است.
مولکول های یک ماده در حال جنبش و حرکت دایمی هستند. این جنبش مولکول ها حرکت براونی نام دارد که برای اولین بار توسط روبرت براون در سال ۱۸۲۱میلادی کشف شده است. وقتی ماده به شکل گاز است مولکول ها دارای جنبش بسیار زیاد هستند و فضای بین مولکولها زیاد است. در حالت مایع فضای بین مولکولی کمتر و جنبش مولکول ها نیز کمتر است. در حالت جامد مولکول ها به صورت منظم چیده شده اند و دارای چرخش به دور یک فضای مشخص هستند. دمای یک ماده نشانگر میزان جنبش مولکول های آن ماده است.
نیروی واندروالسی نیروی ضعیفی ست که عامل جاذبه بین مولکول هاست.


wiki: مولکول
دانشنامه آزاد فارسی
مولِکول (molecule)
مولِکول
کوچک ترین ذرۀ یک ترکیب یا یک عنصر که می تواند مستقلاً وجود داشته باشد. اتم های هیدروژن در دمای اتاق نمی توانند به تنهایی وجود داشته باشند، لذا با یکدیگر ترکیب شده و هیدروژن مولکولی تولید می کنند. هر مولکول ترکیب دو یا چند اتم گوناگون است که با یکدیگر پیوند برقرار کرده اند. مولکول ها، از مولکول هیدروژن (H۲) تا درشت مولکول های پروتئینی، از لحاظ اندازه و پیچیدگی با هم فرق دارند. مولکول ها ممکن است از طریق پیوندهای یونی کنار هم قرار گیرند که در آن، اتم ها برای تشکیل یون ها یا الکترون می گیرند یا الکترون از دست می دهند. همچنین، مولکول ها از طریق پیوند های کئووالانی نیز تشکیل می شوند که در آن، الکترون های هر اتم در یک اربیتال مولکولی جدید به اشتراک گذاشته می شوند. هر ترکیب با یک فرمول شیمیایی نشان داده می شود که نشانگر عناصری است که ترکیب می تواند به آن ها شکسته شود. فرمول نوع و تعداد اتم ها را نیز بیان می کند. نمایش سمبلیک یک مولکول به فرمول مولکولیمعروف است. مثلاً مولکول آب دارای دو اتم هیدروژن و یک اتم اکسیژن است و آن را باH۲O نشان می دهند.نظریۀ جنبشی ماده(نظریۀ جنبشی ماده). بنا به نظریۀ سینتیکی یا نظریۀ مولکولی ماده، ماده از مولکول هایی ساخته شده است که متحرک اند و مقدار این حرکت به دمای آن ها بستگی دارد. مولکول ها نیروهایی نیز بر هم وارد می کنند. ماهیت و قدرت این نیروها بستگی به دما و حالت ماده (جامد، مایع، و گاز) دارد. برای اولین بار در ۱۸۱۱ به واسطۀ فرضیه فیزیک دان ایتالیایی، آمادِئو آووگادرو، به موجودیت مولکول ها پی برده شد. او مشاهده کرد که ترکیب گازها با نسبت های ساده ای صورت می گیرد. مثلاً یک حجم از اکسیژن با دو حجم از هیدروژن ترکیب می شود و آب را تولید می کند و فرض کرد در حجم های مساوی از گازها در دما و فشار یکسان، تعداد مولکول ها مساوی است. فرضیۀ آووگادرو در ۱۸۶۰ و زمانی قبول عام یافت که شیمی دان ایتالیایی، استانیسیلائو کانیتسارو، آن را پیش نهاد. جابه جایی برخی از مولکول ها را می توان با میکروسکوپ مشاهده کرد. در اوایل ۱۸۲۷، روبرت براون مشاهده کرد بسیاری از دانه های ریز گرده که در آب معلق بودند، نامنظم و پی درپی حرکت می کنند. این جنبش تصادفی و مداوم ذرات در یک حلال مانند گاز یا مایع، به طوری که ذرات در حال برخورد با مولکول های حلال باشند، به حرکت براونی معروف است. این جابه جایی خودبه خودی و تصادفی مولکول ها یا ذرات در یک حلال به شکل نفوذ یا انتشار هم دیده می شود، به طوری که ذرات از محلی با غلظت بالایی به محلی نفوذ می کنند که غلظت کمی دارد و این کار تا وقتی که غلظت یکنواختی در سراسر حلال پدید آید ادامه می یابد. در این جا هم زدن یا مخلوط کردن مکانیکی در نظر نیست. مثلاً اگر یک قطره جوهر به آب افزوده شود، مولکول های جوهر در آب پراکنده می شوند تا وقتی که جوهر به صورت یکنواخت در سراسر حلال، در این جا آب، پخش شود. نظریۀ جنبشی گازها اثر فشار، دما، و حجم بر گازها طی قرون ۱۷ و ۱۸ بررسی شد. بر اساس قانون بویل، برای جرم ثابتی از گاز، حجم گاز در دمای ثابت به صورت معکوس با فشار متناسب است. بر اساس قانون شارل، برای جرم ثابتی از گاز، حجم گاز در فشار ثابت متناسب با دمای مطلق است. بنا به قانون فشار، فشار جرم ثابتی از گاز در حجم ثابت، مستقیماً متناسب با دمای مطلق آن است. مجموعه این قوانین به قوانین گازها معروف اند و به این صورت بیان می شوند:(فرمول ۱).
فرمول ۱:
نمودار حجم یک گاز بر اساس دمای آن خط راستی است که نشان می دهد این دو عامل با یکدیگر متناسب اند. این خط محور ایکس را در ۲۷۳- درجۀ سانتی گراد قطع می کند. از این رو، می توان گفت اگر گاز در ابتدا به شکل مایع نباشد، در دمای ۲۷۳- درجۀ سانتی گراد، حجم آن صفر خواهد بود. به این دما صفر مطلق یا صفر در مقیاس کلوین می گویند (۰K) و پایین ترین دمای ممکن از لحاظ نظری است. چنین رفتاری فقط برای گازهای ایده آل در نظر گرفته می شود. گازهای ایده آل گازهایی اند که حجم ناچیزی را اشغال می کنند، به قسمی که حجم قابل صرف نظر است و نیروهای بین ذرات نیز در آن ها قابل چشم پوشی است. از آن جایی که گاز حقیقی رفتاری متفاوت با گازهای ایده آل دارد، قانون واندروالسشامل فاکتور تصحیحی است که در قوانین گازها اعمال می شود تا رفتار غیر ایده آل گازهای حقیقی را نیز بتوان محاسبه کرد.
تغییر حالت. وقتی ماده گرم شود، ممکن است دمای آن افزایش یابد که منجر به تغییر حالت آن ماده می شود. زمانی که انرژی درونی ماده زیاد می شود، انرژی گرفته شدۀ هر ذره نیز افزایش می یابد، از این رو، تحرک ذرات و انرژی سینیتکی ذرات بیشتر می شود. این تحرک و جابه جایی موجب تشدید ارتعاش و چرخش مولکول ها می شود. در این حالت فرض بر این است که جسم بیش از یک اتم دارد. یک جامد از ذراتی تشکیل شده است که با نیروهایی در کنار هم قرار گرفته اند .هنگامی که به جامدی حرارت می دهیم، ذرات آن به شدت مرتعش می شوند و فضای بیشتری را اشغال می کنند. این امر منجر به انبساط ماده می شود .وقتی که دمای جامد افزایش یابد، ذرات آن به حالت مایع درمی آیند که در این حالت آزادی عمل بیشتری دارند، ولی به هر حال باز هم نیروهایی بین آن ها وجود دارد .در صورتی که به ماده انرژی بیشتری داده شود، ذرات سریع تر حرکت می کنند تا بر این نیروها غلبه کنند. در نقطۀ جوش، مایع می جوشد و به گاز تبدیل می شود. ذرات گاز مستقل از هم حرکت می کنند، جز زمانی که با هم برخورد کنند .برای این که دمای اجسام به مقدار مشابهی تغییر کند، به مقدار انرژی گرمایی متفاوتی نیاز است. به عبارت دیگر، اگر بخواهیم دمای چند شیء متفاوت را به یک مقدار مشابه بالا ببریم مقدار انرژی های متفاوتی نیاز داریم. ظرفیت گرمایی یک شیء مقدار گرمایی است که دمای آن شیء را یک درجه افزایش می دهد. ظرفیت گرمایی ویژه یک جسم ظرفیت گرمایی در واحد جرم است و بر حسب ژول بر کیلوگرم کلوین اندازه گیری می شود. وقتی که جسم حین گرم شدن تغییر حالت می دهد، دمای آن ثابت است، حتی اگر انرژی گرمایی بالا رود مثلاً آب در دمای ثابتی می جوشد و بخار می شود. انرژی لازم برای تغییر حالت یک جسم را گرمای پنهان می گویند. این انرژی برای غلبه بر نیروهای نگه دارندۀ ذرات به کار می رود، به طوری که با غلبه بر این نیروها تغییر حالت ماده رخ می دهد. گرمای پنهان ویژه انرژی گرمایی لازم برای تغییر حالت جرم معینی از ماده ای خاص است، بدون این که دما تغییر کند. وقتی که مایعی تبخیر شود، عمل تبخیر موجب خنک شدن مایع می گردد. جابه جایی ذرات بر اثر انرژی سینیتکی موجب می شود گرما از طریق هدایت، همرفت و تشعشع انتقال یابد. هدایت جابه جایی گرما در مادۀ جامد است و از طریق الکترون های آزاد صورت می گیرد. همرفت انتقال انرژی از طریق جابه جایی ذرات است. جریان های همرفتی بر اثر افزایش دمای مایعات و گازها و انبساط آن ها ایجاد می شوند. مادۀ منبسط شده چگالی کمتری دارد و روی ماده سردتر و چگال تر قرار می گیرد.
اندازه و شکل مولکول ها. شکل یک مولکول شدیداً بر خواص بیولوژیکی، فیزیکی، و شیمیایی آن اثر می گذارد. ایزومرهای نوری یا مولکول هایی که تصاویر آینه ای هم اند، صفحۀ نوری پلاریزه شده را در جهت های مخالف هم می چرخانند. ایزومرهای مولکول های دارویی ممکن است اثرات بیولوژیکی متفاوتی داشته باشند .واکنش های آنزیمی شدیداً به شکل آنزیم و جسمی بستگی دارد که آنزیم روی آن عمل می کند. شیمی دان های آلمانی در ۱۹۹۵، مولکولی دایره ای شکل شامل ۷۰۰ اتم ساختند که جرم مولکولی نسبی آن حدود ۲۴هزار بود. این مولکول دارای ۱۵۴ اتم مولیبدن بود که با اتم های اکسیژن احاطه شده بودند و به طبقه ای از ترکیبات با نام کلاسترهای فلزی تعلق داشت.
مولِکول
کوچک ترین ذرۀ یک ترکیب یا یک عنصر که می تواند مستقلاً وجود داشته باشد. اتم های هیدروژن در دمای اتاق نمی توانند به تنهایی وجود داشته باشند، لذا با یکدیگر ترکیب شده و هیدروژن مولکولی تولید می کنند. هر مولکول ترکیب دو یا چند اتم گوناگون است که با یکدیگر پیوند برقرار کرده اند. مولکول ها، از مولکول هیدروژن (H۲) تا درشت مولکول های پروتئینی، از لحاظ اندازه و پیچیدگی با هم فرق دارند. مولکول ها ممکن است از طریق پیوندهای یونی کنار هم قرار گیرند که در آن، اتم ها برای تشکیل یون ها یا الکترون می گیرند یا الکترون از دست می دهند. همچنین، مولکول ها از طریق پیوند های کئووالانی نیز تشکیل می شوند که در آن، الکترون های هر اتم در یک اربیتال مولکولی جدید به اشتراک گذاشته می شوند. هر ترکیب با یک فرمول شیمیایی نشان داده می شود که نشانگر عناصری است که ترکیب می تواند به آن ها شکسته شود. فرمول نوع و تعداد اتم ها را نیز بیان می کند. نمایش سمبلیک یک مولکول به فرمول مولکولیمعروف است. مثلاً مولکول آب دارای دو اتم هیدروژن و یک اتم اکسیژن است و آن را باH۲O نشان می دهند.نظریۀ جنبشی ماده(نظریۀ جنبشی ماده). بنا به نظریۀ سینتیکی یا نظریۀ مولکولی ماده، ماده از مولکول هایی ساخته شده است که متحرک اند و مقدار این حرکت به دمای آن ها بستگی دارد. مولکول ها نیروهایی نیز بر هم وارد می کنند. ماهیت و قدرت این نیروها بستگی به دما و حالت ماده (جامد، مایع، و گاز) دارد. برای اولین بار در ۱۸۱۱ به واسطۀ فرضیه فیزیک دان ایتالیایی، آمادِئو آووگادرو، به موجودیت مولکول ها پی برده شد. او مشاهده کرد که ترکیب گازها با نسبت های ساده ای صورت می گیرد. مثلاً یک حجم از اکسیژن با دو حجم از هیدروژن ترکیب می شود و آب را تولید می کند و فرض کرد در حجم های مساوی از گازها در دما و فشار یکسان، تعداد مولکول ها مساوی است. فرضیۀ آووگادرو در ۱۸۶۰ و زمانی قبول عام یافت که شیمی دان ایتالیایی، استانیسیلائو کانیتسارو، آن را پیش نهاد. جابه جایی برخی از مولکول ها را می توان با میکروسکوپ مشاهده کرد. در اوایل ۱۸۲۷، روبرت براون مشاهده کرد بسیاری از دانه های ریز گرده که در آب معلق بودند، نامنظم و پی درپی حرکت می کنند. این جنبش تصادفی و مداوم ذرات در یک حلال مانند گاز یا مایع، به طوری که ذرات در حال برخورد با مولکول های حلال باشند، به حرکت براونی معروف است. این جابه جایی خودبه خودی و تصادفی مولکول ها یا ذرات در یک حلال به شکل نفوذ یا انتشار هم دیده می شود، به طوری که ذرات از محلی با غلظت بالایی به محلی نفوذ می کنند که غلظت کمی دارد و این کار تا وقتی که غلظت یکنواختی در سراسر حلال پدید آید ادامه می یابد. در این جا هم زدن یا مخلوط کردن مکانیکی در نظر نیست. مثلاً اگر یک قطره جوهر به آب افزوده شود، مولکول های جوهر در آب پراکنده می شوند تا وقتی که جوهر به صورت یکنواخت در سراسر حلال، در این جا آب، پخش شود. نظریۀ جنبشی گازها اثر فشار، دما، و حجم بر گازها طی قرون ۱۷ و ۱۸ بررسی شد. بر اساس قانون بویل، برای جرم ثابتی از گاز، حجم گاز در دمای ثابت به صورت معکوس با فشار متناسب است. بر اساس قانون شارل، برای جرم ثابتی از گاز، حجم گاز در فشار ثابت متناسب با دمای مطلق است. بنا به قانون فشار، فشار جرم ثابتی از گاز در حجم ثابت، مستقیماً متناسب با دمای مطلق آن است. مجموعه این قوانین به قوانین گازها معروف اند و به این صورت بیان می شوند:(فرمول ۱).
فرمول ۱:
نمودار حجم یک گاز بر اساس دمای آن خط راستی است که نشان می دهد این دو عامل با یکدیگر متناسب اند. این خط محور ایکس را در ۲۷۳- درجۀ سانتی گراد قطع می کند. از این رو، می توان گفت اگر گاز در ابتدا به شکل مایع نباشد، در دمای ۲۷۳- درجۀ سانتی گراد، حجم آن صفر خواهد بود. به این دما صفر مطلق یا صفر در مقیاس کلوین می گویند (۰K) و پایین ترین دمای ممکن از لحاظ نظری است. چنین رفتاری فقط برای گازهای ایده آل در نظر گرفته می شود. گازهای ایده آل گازهایی اند که حجم ناچیزی را اشغال می کنند، به قسمی که حجم قابل صرف نظر است و نیروهای بین ذرات نیز در آن ها قابل چشم پوشی است. از آن جایی که گاز حقیقی رفتاری متفاوت با گازهای ایده آل دارد، قانون واندروالسشامل فاکتور تصحیحی است که در قوانین گازها اعمال می شود تا رفتار غیر ایده آل گازهای حقیقی را نیز بتوان محاسبه کرد.
تغییر حالت. وقتی ماده گرم شود، ممکن است دمای آن افزایش یابد که منجر به تغییر حالت آن ماده می شود. زمانی که انرژی درونی ماده زیاد می شود، انرژی گرفته شدۀ هر ذره نیز افزایش می یابد، از این رو، تحرک ذرات و انرژی سینیتکی ذرات بیشتر می شود. این تحرک و جابه جایی موجب تشدید ارتعاش و چرخش مولکول ها می شود. در این حالت فرض بر این است که جسم بیش از یک اتم دارد. یک جامد از ذراتی تشکیل شده است که با نیروهایی در کنار هم قرار گرفته اند .هنگامی که به جامدی حرارت می دهیم، ذرات آن به شدت مرتعش می شوند و فضای بیشتری را اشغال می کنند. این امر منجر به انبساط ماده می شود .وقتی که دمای جامد افزایش یابد، ذرات آن به حالت مایع درمی آیند که در این حالت آزادی عمل بیشتری دارند، ولی به هر حال باز هم نیروهایی بین آن ها وجود دارد .در صورتی که به ماده انرژی بیشتری داده شود، ذرات سریع تر حرکت می کنند تا بر این نیروها غلبه کنند. در نقطۀ جوش، مایع می جوشد و به گاز تبدیل می شود. ذرات گاز مستقل از هم حرکت می کنند، جز زمانی که با هم برخورد کنند .برای این که دمای اجسام به مقدار مشابهی تغییر کند، به مقدار انرژی گرمایی متفاوتی نیاز است. به عبارت دیگر، اگر بخواهیم دمای چند شیء متفاوت را به یک مقدار مشابه بالا ببریم مقدار انرژی های متفاوتی نیاز داریم. ظرفیت گرمایی یک شیء مقدار گرمایی است که دمای آن شیء را یک درجه افزایش می دهد. ظرفیت گرمایی ویژه یک جسم ظرفیت گرمایی در واحد جرم است و بر حسب ژول بر کیلوگرم کلوین اندازه گیری می شود. وقتی که جسم حین گرم شدن تغییر حالت می دهد، دمای آن ثابت است، حتی اگر انرژی گرمایی بالا رود مثلاً آب در دمای ثابتی می جوشد و بخار می شود. انرژی لازم برای تغییر حالت یک جسم را گرمای پنهان می گویند. این انرژی برای غلبه بر نیروهای نگه دارندۀ ذرات به کار می رود، به طوری که با غلبه بر این نیروها تغییر حالت ماده رخ می دهد. گرمای پنهان ویژه انرژی گرمایی لازم برای تغییر حالت جرم معینی از ماده ای خاص است، بدون این که دما تغییر کند. وقتی که مایعی تبخیر شود، عمل تبخیر موجب خنک شدن مایع می گردد. جابه جایی ذرات بر اثر انرژی سینیتکی موجب می شود گرما از طریق هدایت، همرفت و تشعشع انتقال یابد. هدایت جابه جایی گرما در مادۀ جامد است و از طریق الکترون های آزاد صورت می گیرد. همرفت انتقال انرژی از طریق جابه جایی ذرات است. جریان های همرفتی بر اثر افزایش دمای مایعات و گازها و انبساط آن ها ایجاد می شوند. مادۀ منبسط شده چگالی کمتری دارد و روی ماده سردتر و چگال تر قرار می گیرد.
اندازه و شکل مولکول ها. شکل یک مولکول شدیداً بر خواص بیولوژیکی، فیزیکی، و شیمیایی آن اثر می گذارد. ایزومرهای نوری یا مولکول هایی که تصاویر آینه ای هم اند، صفحۀ نوری پلاریزه شده را در جهت های مخالف هم می چرخانند. ایزومرهای مولکول های دارویی ممکن است اثرات بیولوژیکی متفاوتی داشته باشند .واکنش های آنزیمی شدیداً به شکل آنزیم و جسمی بستگی دارد که آنزیم روی آن عمل می کند. شیمی دان های آلمانی در ۱۹۹۵، مولکولی دایره ای شکل شامل ۷۰۰ اتم ساختند که جرم مولکولی نسبی آن حدود ۲۴هزار بود. این مولکول دارای ۱۵۴ اتم مولیبدن بود که با اتم های اکسیژن احاطه شده بودند و به طبقه ای از ترکیبات با نام کلاسترهای فلزی تعلق داشت.
wikijoo: مولکول
پیشنهاد کاربران
خوژ یا خوژه؛
خوژه: خوشه ژه= خوشه ی کوچک
[ریژ=اتم]
مولکول، خوشه ای از ریژها یا اتمهاست بنابراین می توانیم از واژه ی خوشه برای واژه سازی بهره بریم و با پسوند کوچکساز [ژه] به دلخواه خودمان برسیم: "خوشه ژه"
... [مشاهده متن کامل]
واژه ی خوشه ژه را برای کوتاه تر و خوش آواتر شدن به خوژه یا خوژ دگردیس می کنیم.
خوژان از به هم پیوستن ریژان ساخته می شوند.
خوژه: خوشه ژه= خوشه ی کوچک
[ریژ=اتم]
مولکول، خوشه ای از ریژها یا اتمهاست بنابراین می توانیم از واژه ی خوشه برای واژه سازی بهره بریم و با پسوند کوچکساز [ژه] به دلخواه خودمان برسیم: "خوشه ژه"
... [مشاهده متن کامل]
واژه ی خوشه ژه را برای کوتاه تر و خوش آواتر شدن به خوژه یا خوژ دگردیس می کنیم.
خوژان از به هم پیوستن ریژان ساخته می شوند.
ذره ای که از اتصال چند اتم به وجود میاد. مثلاً H₂O یه مولکوله.
تو زبان مازندرانی که ریشه زبان ایرانی پهلوی دارد اینها کاربرد دارد
قطره = چکه / حبه ( برابر با cube لاتین و حبوبات یا قطره ها از اینجا امده ) / پِندیک ( پند اند ایک = یه هوا یا یه مقداری = ذره ) این واژه با پنداشتن که پند آن یعنی هوا یا خیال برابر است ؛ یعنی چیز بسیار اندکی که به فکر برسد از همینرو به و در برخی جاها میگویند 5 کیلو هُ اندی و اندی یعنی مقداری / ذره ای چیزی که شمارشی ( تعدادی ) نیست و کشیدنی می باشد پس پَندیک یا اندیک یعنی ذره / مقدار / قطره اما چون از پَند برای فکر و سگال بهره برده شده بهتر است از اندیک برای قطره و اندیکات برای قطرات بهره ببربم
... [مشاهده متن کامل]
زیر قطره های بارون = زیر ( چکه های/ اندیکات ) بارون ( برای مولکول هم میشه ازش استفاده کرد )
چند قطره ( چکه / حبه / اندیک ) از آن نمونه برداری شد
5 کیلو هُ اَندی = 5 کیلو هُ مقداری واژه چند = چ اند یعنی چ مقدار یا ذره یا قطره ( چون همگی آنها قابل شمارش نیستند و وزنی بشمار میان ) پس اَندی و پندیک یعنی ذره / مقدار / قطره
قطره = چکه / حبه
قطرات آب = چکه های آب / حبه های آب ( حبه ایرانیست ) / پندیکات ( قطره های ) آب یا اندیکات آب
الان یافتم که حباب یعنی حبه های آب و چه زیبا فهمیدم این حباب ( ذره های آب ) هم ایرانیست.
دو واژه کودک و کوچک داریم
کودک ( ک نشانه کوچکی و دک یعنی دک و پز یا جلو آمده یا رشد یافته که منظور همان اعضا بوده پس میشود کوچک اندام )
کوچک ( ک نشانه کوچکی و چک یعنی دانه = ریز دانه ) در جاهای دیگر استفاده شدند هر چند شاید بتوان از کوچک همچنان برای مولکول بهره برد اما برابر دیگر آن کِچِک یا کچیک است چک و چیک شدن قطره / ذره / مولکول
مولکول های آب = کِچیک های آب
قطرات / قطره های آب = چکه ها / حبه ها / اندیکات آب
قطره = چکه / حبه ( برابر با cube لاتین و حبوبات یا قطره ها از اینجا امده ) / پِندیک ( پند اند ایک = یه هوا یا یه مقداری = ذره ) این واژه با پنداشتن که پند آن یعنی هوا یا خیال برابر است ؛ یعنی چیز بسیار اندکی که به فکر برسد از همینرو به و در برخی جاها میگویند 5 کیلو هُ اندی و اندی یعنی مقداری / ذره ای چیزی که شمارشی ( تعدادی ) نیست و کشیدنی می باشد پس پَندیک یا اندیک یعنی ذره / مقدار / قطره اما چون از پَند برای فکر و سگال بهره برده شده بهتر است از اندیک برای قطره و اندیکات برای قطرات بهره ببربم
... [مشاهده متن کامل]
زیر قطره های بارون = زیر ( چکه های/ اندیکات ) بارون ( برای مولکول هم میشه ازش استفاده کرد )
چند قطره ( چکه / حبه / اندیک ) از آن نمونه برداری شد
5 کیلو هُ اَندی = 5 کیلو هُ مقداری واژه چند = چ اند یعنی چ مقدار یا ذره یا قطره ( چون همگی آنها قابل شمارش نیستند و وزنی بشمار میان ) پس اَندی و پندیک یعنی ذره / مقدار / قطره
قطره = چکه / حبه
قطرات آب = چکه های آب / حبه های آب ( حبه ایرانیست ) / پندیکات ( قطره های ) آب یا اندیکات آب
الان یافتم که حباب یعنی حبه های آب و چه زیبا فهمیدم این حباب ( ذره های آب ) هم ایرانیست.
دو واژه کودک و کوچک داریم
کودک ( ک نشانه کوچکی و دک یعنی دک و پز یا جلو آمده یا رشد یافته که منظور همان اعضا بوده پس میشود کوچک اندام )
کوچک ( ک نشانه کوچکی و چک یعنی دانه = ریز دانه ) در جاهای دیگر استفاده شدند هر چند شاید بتوان از کوچک همچنان برای مولکول بهره برد اما برابر دیگر آن کِچِک یا کچیک است چک و چیک شدن قطره / ذره / مولکول
مولکول های آب = کِچیک های آب
قطرات / قطره های آب = چکه ها / حبه ها / اندیکات آب
🇮🇷 واژه ی برنهاده: مولکول 🇮🇷
مولکول = مورول :
مور = بسیار ، فراوان
اوول یا اوولو یا اووله = پسوند خُردی یا کوچکی مانند : کوچول ، کوچولو
مورغاله : مور - غاله
غاله : پسوند خُردی ، مِسلِ : بُزغاله ، جِزغاله
مور = بسیار ، فراوان
اوول یا اوولو یا اووله = پسوند خُردی یا کوچکی مانند : کوچول ، کوچولو
مورغاله : مور - غاله
غاله : پسوند خُردی ، مِسلِ : بُزغاله ، جِزغاله
مولکول
مورَک، مورین، موراله، موربَس ( بسیار مور=ریز )
هَسته مند، هَسمند، هَستار
مورَک، مورین، موراله، موربَس ( بسیار مور=ریز )
هَسته مند، هَسمند، هَستار
