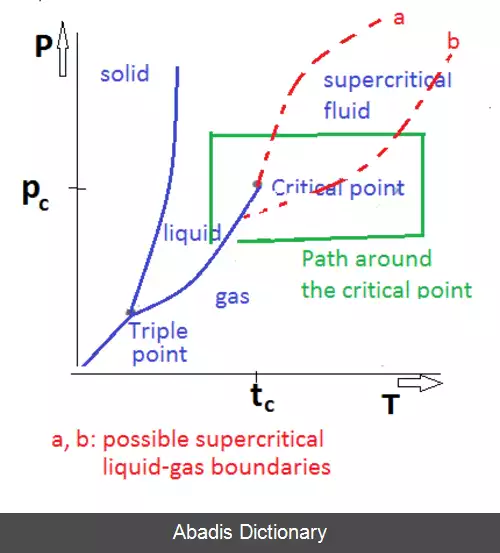
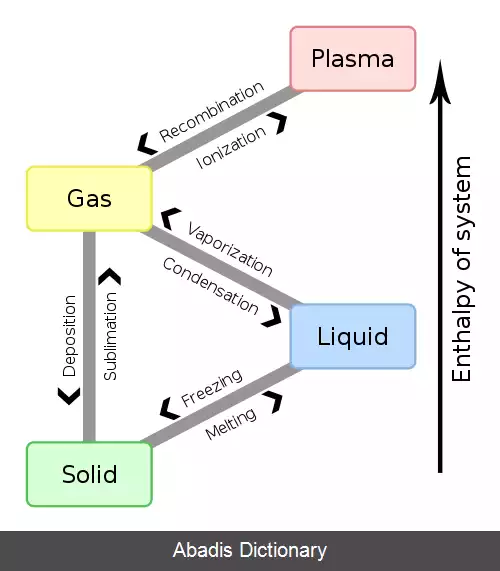
سیال فوق بحرانی ( انگلیسی:supercritical fluid ) به هر ماده ای که بالاتر از فشار و دمای آن در نقطه بحرانی باشد گفته می شود. جائی که فازهای گاز و مایع از یکدیگر متمایز نیستند. این گونه از سیالات می توانند همچون گازها بینابین جامدات پراکنده شوند یا به مانند مایعات، مواد را در خود حل کنند. در نزدیکی نقطه بحرانی هر گونه تغییر اندک در فشار یا دما باعث یک تغییر عظیم در چگالی می شود. سیالات فوق بحرانی بسیار مناسب جهت جایگزینی برای حلال های ارگانیگ در فرایندهای صنعتی و آزمایشگاهی هستند. از پرکاربردترین سیالات فوق بحرانی می توان به کربن دی اکسید و آب اشاره کرد که در کافئین زدایی و تولید قدرت ( نیروگاه ها ) استفاده می شوند.
در ویژگی های عمومی، سیالات فوق بحرانی ویژگی های تلفیقی از گاز و مایع را دارا می باشند. در جدول ۱، ویژگی های بحرانی چند ماده فوق بحرانی آورده شده است.
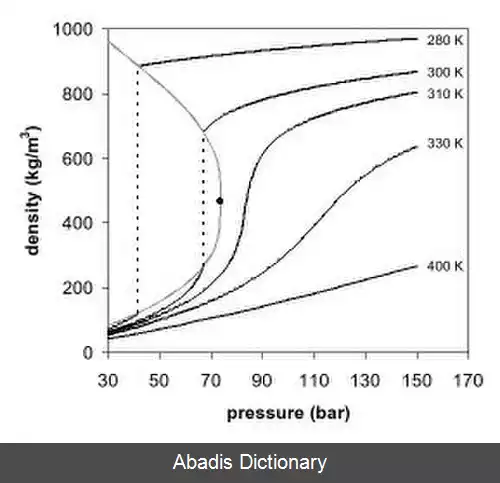
در سیال های فوق بحرانی، هیچ گونه کشش سطحی وجود ندارد. این بدین دلیل است که در آن دما و فشار، هیچ گونه مرزی بین فاز های گاز و مایع وجود ندارد. با ایجاد تغییر در دما یا گاز سیال، می توان ویژگی های سیال را به گونه ای تنظیم کرد که سیال ما رفتاری همانند گاز یا مایع بگیرد. یکی از مهمترین ویژگی های سیال فوق بحرانی، انحلال پذیری آن است. در دمای ثابت، انحلال پذیری در سیال فوق بحرانی با چگالی آن رابطه مستقیم دارد. از طرفی تغیرات در فشار باعث تا ایجاد تغییرات در چگالی می شود. پس می توان گفت با افزایش فشار، انحلال پذیری سیال افزایش می یابد. رابطه انحلال پذیری با دما کمی پیچیده تر هست. در چگالی ثابت، انحلال پذیری با افزایش دما، افزایش می یابد. اما در نزدیکی نقطه بحرانی چگالی دچار یک افت شدید می شود که با افزایش دمای اندکی همراه است. در هر حال در نزدیکی دمای بحرانی، در اکثر مواقع، انحلال پذیری با افزایش دما، کاهش می یابد و پس از مدتی، دوباره افزایش می یابد. [ ۲]
همه سیالات فوق بحرانی نسبت به یک دیگر قابلیت امتزاج دارند. پس می توان یک محلول دو فازی را با رسیدن به دمای فوق بحرانی به یک محلول تک فازی تبدیل کرد. دمای بحرانی محلول جدید را نیز می توان را با میانگین حسابی گرفتن از دما و فشار بحرانی دو جز تخمین زد.
با استفاده از معادلات حالت، چون پنگ رابینسون ( Peng Robinson ) یا روش مشارکت گروهی ( group contribution ) می توان دمای بحرانی یا دیگر ویژگی ها همچون چگالی را با دقت بالا به دست آورد. [ ۳]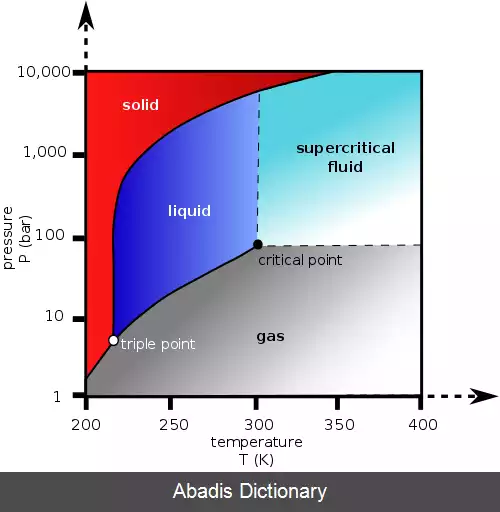

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر ویژگی های عمومی، سیالات فوق بحرانی ویژگی های تلفیقی از گاز و مایع را دارا می باشند. در جدول ۱، ویژگی های بحرانی چند ماده فوق بحرانی آورده شده است.
در سیال های فوق بحرانی، هیچ گونه کشش سطحی وجود ندارد. این بدین دلیل است که در آن دما و فشار، هیچ گونه مرزی بین فاز های گاز و مایع وجود ندارد. با ایجاد تغییر در دما یا گاز سیال، می توان ویژگی های سیال را به گونه ای تنظیم کرد که سیال ما رفتاری همانند گاز یا مایع بگیرد. یکی از مهمترین ویژگی های سیال فوق بحرانی، انحلال پذیری آن است. در دمای ثابت، انحلال پذیری در سیال فوق بحرانی با چگالی آن رابطه مستقیم دارد. از طرفی تغیرات در فشار باعث تا ایجاد تغییرات در چگالی می شود. پس می توان گفت با افزایش فشار، انحلال پذیری سیال افزایش می یابد. رابطه انحلال پذیری با دما کمی پیچیده تر هست. در چگالی ثابت، انحلال پذیری با افزایش دما، افزایش می یابد. اما در نزدیکی نقطه بحرانی چگالی دچار یک افت شدید می شود که با افزایش دمای اندکی همراه است. در هر حال در نزدیکی دمای بحرانی، در اکثر مواقع، انحلال پذیری با افزایش دما، کاهش می یابد و پس از مدتی، دوباره افزایش می یابد. [ ۲]
همه سیالات فوق بحرانی نسبت به یک دیگر قابلیت امتزاج دارند. پس می توان یک محلول دو فازی را با رسیدن به دمای فوق بحرانی به یک محلول تک فازی تبدیل کرد. دمای بحرانی محلول جدید را نیز می توان را با میانگین حسابی گرفتن از دما و فشار بحرانی دو جز تخمین زد.
با استفاده از معادلات حالت، چون پنگ رابینسون ( Peng Robinson ) یا روش مشارکت گروهی ( group contribution ) می توان دمای بحرانی یا دیگر ویژگی ها همچون چگالی را با دقت بالا به دست آورد. [ ۳]





wiki: سیال فوق بحرانی
