اسید سولفوریک که در گذشته جوهر گوگرد خوانده می شد، نوعی اسید معدنی است که از عناصر گوگرد، اکسیژن و هیدروژن تشکیل می شود و فرمول شیمیایی آن H2SO4 است. این ماده یک مایع بی رنگ، بی بو، و با گرانروی بالا است که در آب انحلال پذیر بوده و واکنش ترکیب شدن آن با آب بسیار گرمازا است. [ ۱]
حجم تولید این ماده در جهان به قدری بالاست که معمولاً از آن به عنوان «سلطان مواد شیمیایی» یاد می شود. [ ۲] در حقیقت این اسید به قدری با اهمیت است که سرانه مصرف آن به ازای هر فرد، یکی از شاخص های تعیین پیشرفت فنی کشورهاست. [ ۲]
اسید سولفوریک با فرایندهای مختلفی تولید می شود، از جمله: فرایند تماسی، فرایند اسیدسولفوریک مرطوب، فرایند محفظه سربی. [ ۳]
اسید سولفوریک یکی از مواد اصلی در صنایع شیمیایی است. در صنعت ساخت کودهای شیمیایی به طور گسترده ای از آن استفاده می شود. [ ۴] همچنین کاربرد گسترده ای در فراوری سنگ ها و مواد معدنی، پالایشگاه نفت، تصفیه فاضلاب و سنتز شیمیایی دارد.
اسید سولفوریک برای نخستین بار توسط جابر بن حیان کشف شد. [ ۵] [ ۶] [ ۷] [ ۸] او با تقطیر کانی های سولفات آهن ( معروف به زاج سبز ) ( آهن سولفات هفت آبه به فرمول FeSO4. 7H2O ) و مس ( II ) سولفات، این اسید را به دست آورد.
این ماده دارای مولکول های دارای گشتاور قطبی است که می توانند با یک دیگر پیوند هیدروژنی برقرار کنند. پس سولفوریک اسید مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز ( دارای گران روی زیاد ) محسوب می شود. همین شرایط مولکولی باعث می شوند که سولفوریک اسید به خوبی در آب حل شود و محلول های اسیدی مختلف تولید کند.
این ماده از مولکول هایی شامل یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن ساخته شده است. از آن جا که هیدروژن ها به اتم اکسیژن متصل هستند، حامل بار مثبت جزئی می باشند و قادرند به عنوان هیدروژن اسیدی عمل کنند. با از دست دادن اولین هیدروژن، آنیون هیدروژن سولفات تولید می شود که با توجه به ساختارهای رزونانسی، بسیار پایدار است؛ بنابراین اولین تفکیک سولفوریک اسید، به شکل کامل انجام می شود:
۱ ) H2SO4 + H2O → HSO4 - + H3O+
برای دومین مرحله، باید هیدروژن به شکل کاتیون، آنیون هیدروژن سولفات را ترک کند که چندان راحت نیست؛ بنابراین تفکیک دومین هیدروژن اسیدی در سولفوریک اسید، کامل نیست و یک واکنش تعادلی است:[ ۹]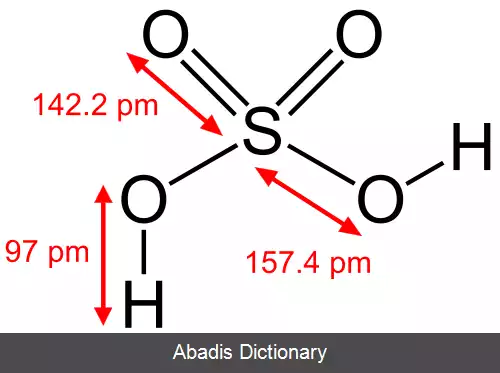

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفحجم تولید این ماده در جهان به قدری بالاست که معمولاً از آن به عنوان «سلطان مواد شیمیایی» یاد می شود. [ ۲] در حقیقت این اسید به قدری با اهمیت است که سرانه مصرف آن به ازای هر فرد، یکی از شاخص های تعیین پیشرفت فنی کشورهاست. [ ۲]
اسید سولفوریک با فرایندهای مختلفی تولید می شود، از جمله: فرایند تماسی، فرایند اسیدسولفوریک مرطوب، فرایند محفظه سربی. [ ۳]
اسید سولفوریک یکی از مواد اصلی در صنایع شیمیایی است. در صنعت ساخت کودهای شیمیایی به طور گسترده ای از آن استفاده می شود. [ ۴] همچنین کاربرد گسترده ای در فراوری سنگ ها و مواد معدنی، پالایشگاه نفت، تصفیه فاضلاب و سنتز شیمیایی دارد.
اسید سولفوریک برای نخستین بار توسط جابر بن حیان کشف شد. [ ۵] [ ۶] [ ۷] [ ۸] او با تقطیر کانی های سولفات آهن ( معروف به زاج سبز ) ( آهن سولفات هفت آبه به فرمول FeSO4. 7H2O ) و مس ( II ) سولفات، این اسید را به دست آورد.
این ماده دارای مولکول های دارای گشتاور قطبی است که می توانند با یک دیگر پیوند هیدروژنی برقرار کنند. پس سولفوریک اسید مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز ( دارای گران روی زیاد ) محسوب می شود. همین شرایط مولکولی باعث می شوند که سولفوریک اسید به خوبی در آب حل شود و محلول های اسیدی مختلف تولید کند.
این ماده از مولکول هایی شامل یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن ساخته شده است. از آن جا که هیدروژن ها به اتم اکسیژن متصل هستند، حامل بار مثبت جزئی می باشند و قادرند به عنوان هیدروژن اسیدی عمل کنند. با از دست دادن اولین هیدروژن، آنیون هیدروژن سولفات تولید می شود که با توجه به ساختارهای رزونانسی، بسیار پایدار است؛ بنابراین اولین تفکیک سولفوریک اسید، به شکل کامل انجام می شود:
۱ ) H2SO4 + H2O → HSO4 - + H3O+
برای دومین مرحله، باید هیدروژن به شکل کاتیون، آنیون هیدروژن سولفات را ترک کند که چندان راحت نیست؛ بنابراین تفکیک دومین هیدروژن اسیدی در سولفوریک اسید، کامل نیست و یک واکنش تعادلی است:[ ۹]



wiki: سولفوریک اسید
