آزمون سنجش پروتئین برادفورد ( همچنین به عنوان آزمون سنجش پروتئین کوماسی شناخته می شود ) توسط ماریون ام. برادفورد در سال 1976 ایجاد شد [ ۱] این یک روش آنالیزی طیف سنجی سریع و دقیق [ ۲] است که برای اندازه گیری غلظت پروتئین در محلول استفاده می شود. این واکنش به ترکیب اسید آمینه های پروتئین اندازه گیری شده بستگی دارد. .
Coomassie Brilliant Blue G - 250. svg
آزمون برادفورد، یک آزمون رنگ سنجی پروتئین، مبتنی بر تغییر جذب رنگ Coomassie brilliant blue G - 250 می باشد. رنگ Coomassie brilliant blue G - 250 به سه شکل آنیونی ( آبی ) ، خنثی ( سبز ) و کاتیونی ( قرمز ) وجود دارد. [ ۳] در شرایط اسیدی، رنگ قرمز به رنگ آبی تبدیل می شود و به پروتئین متصل می شود. اگر هیچ پروتئینی برای اتصال وجود نداشته باشد، محلول قهوه ای باقی خواهد ماند این رنگ توسط نیروی واندروالس و ازطریق برهمکنش های الکترواستاتیکی، یک کمپلکس قوی و غیرکووالانسی با گروه کربوکسیل پروتئین و گروه آمینه تشکیل می دهد. [ ۴] در طی تشکیل این کمپلکس، شکل قرمز رنگ کوماسی ابتدا الکترون آزاد خود را به گروه های یونی روی پروتئین اهدا می کند که باعث تغییر ساختار پروتئین و در نتیجه باز شدن قسمت آبگریز آن می شود. این قسمت های آبگریز در ساختار سوم پروتئین از طریق اولین برهمکنش پیوند ( نیروهای واندروالس ) که گروه های آمین مثبت را در مجاورت بار منفی رنگ قرار می دهد، به صورت غیرکووالانسی به ناحیه غیر قطبی رنگ متصل می شوند. این پیوند با برهمکنش پیوند دوم بین این دو، برهمکنش یونی، بیشتر تقویت می شود. هنگامی که رنگ به پروتئین متصل می شود، باعث تغییر حداکثر جذب از 465 نانومتر به 595 نانومتر می شود به همین دلیل است که قرائت جذب در 595 نانومتر گرفته می شود [ ۵]
شکل کاتیونی ( متصل نشده ) سبز/قرمز است و حداکثر طیف جذبی آن در 465 نانومتر است. شکل آنیونی ( متصل شده ) رنگ که توسط فعل و انفعالات آبگریز و یونی در کنار هم نگه داشته می شود، دارای حداکثر طیف جذبی است که 595 نانومتر است. [ ۶] افزایش جذب در 595 نانومتر با مقدار رنگ متصل شده و در نتیجه با مقدار ( غلظت ) پروتئین موجود در نمونه متناسب است و هر چه رنگ اتصال بیشتری با پروتئین داشته باشد جذب بیشتری به دست می آید. [ ۷]
بر خلاف سایر تست های سنجش پروتئین، آزمایش برادفورد کمتر در معرض تداخل ترکیبات شیمیایی مختلف مانند سدیم، پتاسیم یا حتی کربوهیدرات هایی مانند ساکارز است که ممکن است در نمونه های پروتئینی وجود داشته باشد. [ ۸] ، غلظت بالای دترجنت ها تنها استثناء برای احتمال تداخل در این آزمون است. سدیم دودسیل سولفات ( SDS ) ، یک شوینده متداول است که ممکن است در پروتئین استخراج شده یافت شود، زیرا از آن برای لیز سلولی از طریق تخریب لایه لیپیدی غشایی و دناتوره کردن پروتئین ها برای SDS - PAGE استفاده می شود. در حالی که سایر مواد شوینده در غلظت بالا با این آزمایش تداخل می کنند، تداخل ناشی از SDS در دو حالت مختلف است و هر کدام در غلظت متفاوتی رخ می دهد. هنگامی که غلظت SDS کمتر از غلظت بحرانی میسل ( معروف به CMC، 0. 00333% W/V تا 0. 0667% ) در محلول رنگ کوماسی است ، ماده شوینده تمایل دارد به شدت با پروتئین متصل شود و مکان های اتصال پروتئین را برای معرف رنگ مهار کند. این می تواند باعث کم تخمین زدن غلظت پروتئین در محلول شود. هنگامی که غلظت SDS بالاتر از CMC باشد، مواد شوینده به شدت با شکل سبز رنگ کوماسی مرتبط می شود و باعث می شود تعادل تغییر کند و در نتیجه شکل آبی بیشتری تولید شود. این باعث افزایش جذب در 595نانومتر مستقل از حضور پروتئین می شود . [ ۹]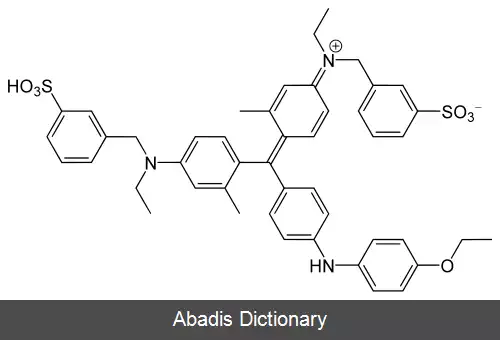
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفCoomassie Brilliant Blue G - 250. svg
آزمون برادفورد، یک آزمون رنگ سنجی پروتئین، مبتنی بر تغییر جذب رنگ Coomassie brilliant blue G - 250 می باشد. رنگ Coomassie brilliant blue G - 250 به سه شکل آنیونی ( آبی ) ، خنثی ( سبز ) و کاتیونی ( قرمز ) وجود دارد. [ ۳] در شرایط اسیدی، رنگ قرمز به رنگ آبی تبدیل می شود و به پروتئین متصل می شود. اگر هیچ پروتئینی برای اتصال وجود نداشته باشد، محلول قهوه ای باقی خواهد ماند این رنگ توسط نیروی واندروالس و ازطریق برهمکنش های الکترواستاتیکی، یک کمپلکس قوی و غیرکووالانسی با گروه کربوکسیل پروتئین و گروه آمینه تشکیل می دهد. [ ۴] در طی تشکیل این کمپلکس، شکل قرمز رنگ کوماسی ابتدا الکترون آزاد خود را به گروه های یونی روی پروتئین اهدا می کند که باعث تغییر ساختار پروتئین و در نتیجه باز شدن قسمت آبگریز آن می شود. این قسمت های آبگریز در ساختار سوم پروتئین از طریق اولین برهمکنش پیوند ( نیروهای واندروالس ) که گروه های آمین مثبت را در مجاورت بار منفی رنگ قرار می دهد، به صورت غیرکووالانسی به ناحیه غیر قطبی رنگ متصل می شوند. این پیوند با برهمکنش پیوند دوم بین این دو، برهمکنش یونی، بیشتر تقویت می شود. هنگامی که رنگ به پروتئین متصل می شود، باعث تغییر حداکثر جذب از 465 نانومتر به 595 نانومتر می شود به همین دلیل است که قرائت جذب در 595 نانومتر گرفته می شود [ ۵]
شکل کاتیونی ( متصل نشده ) سبز/قرمز است و حداکثر طیف جذبی آن در 465 نانومتر است. شکل آنیونی ( متصل شده ) رنگ که توسط فعل و انفعالات آبگریز و یونی در کنار هم نگه داشته می شود، دارای حداکثر طیف جذبی است که 595 نانومتر است. [ ۶] افزایش جذب در 595 نانومتر با مقدار رنگ متصل شده و در نتیجه با مقدار ( غلظت ) پروتئین موجود در نمونه متناسب است و هر چه رنگ اتصال بیشتری با پروتئین داشته باشد جذب بیشتری به دست می آید. [ ۷]
بر خلاف سایر تست های سنجش پروتئین، آزمایش برادفورد کمتر در معرض تداخل ترکیبات شیمیایی مختلف مانند سدیم، پتاسیم یا حتی کربوهیدرات هایی مانند ساکارز است که ممکن است در نمونه های پروتئینی وجود داشته باشد. [ ۸] ، غلظت بالای دترجنت ها تنها استثناء برای احتمال تداخل در این آزمون است. سدیم دودسیل سولفات ( SDS ) ، یک شوینده متداول است که ممکن است در پروتئین استخراج شده یافت شود، زیرا از آن برای لیز سلولی از طریق تخریب لایه لیپیدی غشایی و دناتوره کردن پروتئین ها برای SDS - PAGE استفاده می شود. در حالی که سایر مواد شوینده در غلظت بالا با این آزمایش تداخل می کنند، تداخل ناشی از SDS در دو حالت مختلف است و هر کدام در غلظت متفاوتی رخ می دهد. هنگامی که غلظت SDS کمتر از غلظت بحرانی میسل ( معروف به CMC، 0. 00333% W/V تا 0. 0667% ) در محلول رنگ کوماسی است ، ماده شوینده تمایل دارد به شدت با پروتئین متصل شود و مکان های اتصال پروتئین را برای معرف رنگ مهار کند. این می تواند باعث کم تخمین زدن غلظت پروتئین در محلول شود. هنگامی که غلظت SDS بالاتر از CMC باشد، مواد شوینده به شدت با شکل سبز رنگ کوماسی مرتبط می شود و باعث می شود تعادل تغییر کند و در نتیجه شکل آبی بیشتری تولید شود. این باعث افزایش جذب در 595نانومتر مستقل از حضور پروتئین می شود . [ ۹]


wiki: سنجش پروتئین برادفورد
