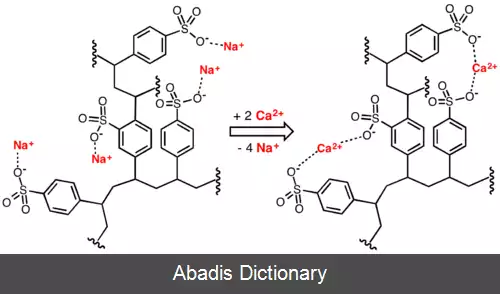
رزین تبادل یونی یا پلیمر تبادل یونی یک رزین یا پلیمر است که به عنوان یک محیط برای مبادله یون عمل می کند. این رزین یک ماتریس نامحلول ( یا ساختار نگهدارنده ) است که به طور معمول در شکل میکرومهره های کوچک ( ۰٫۲۵–۰٫۵ میلی متر شعاع ) ، معمولاً سفید یا زرد، ساخته شده از یک بستر پلیمر ارگانیک می باشد. دانه ها معمولاً متخلخل هستند و مساحت جانبی داخلی و خارجی بالایی ایجاد می کنند. در اصل رزین تبادل یونی یعنی یون هایی که در حال یک واکنش برگشت پذیری هستند که در آن یک یون باردار با یک یون باردار مشابه دیگر به صورت الکترواستاتیک تبادل شوند. به دام افتادن یون ها با آزاد شدن یون های دیگر همراه است، به همین دلیل به آن فرایند تبادل یون گفته می شود. انواع مختلفی از رزین های تبادل یونی وجود دارند. اکثر رزین های موجود در بازار از پلی استایرن سولفونات ساخته شده اند. [ ۱]
رزین های تبادل یونی به طور گسترده ای در فرایندهای جداسازی، تصفیه و ضدعفونی کردن استفاده می شود. شایع ترین کاربردهای آن رسوب زدایی و تصفیه آب است. در بسیاری از کاربردهای این چنینی، رزین های تبادل یونی به عنوان یک جایگزین انعطاف پذیرتر به جای استفاده از زئولیت های طبیعی یا مصنوعی معرفی شدند. همچنین رزین های تبادل یونی در فرایند فیلتراسیون بیودیزل بسیار کاربردی هستند. [ ۲]
پدیده تبادل یون برای اولین بار در سال ۱۸۵۰ و به دنبال مشاهده توانایی خاک های زراعی در تعویض برخی از یون ها مثل آمونیوم با یون کلسیم و منیزم موجود در ساختمان آنها گزارش شد. در سال ۱۸۷۰ با انجام آزمایش های متعددی ثابت شد که بعضی از کانی های طبیعی به خصوص زئولیت ها واجد توانایی انجام تبادل یون هستند. در واقع به رزین های معدنی، زئولیت می گویند و این مواد یون های سختی آور آب ( کلسیم و منیزیم ) را حذف می کردند و به جای آن یون سدیم، آزاد می کردند از این رو به زئولیت های سدیمی مشهور شدند که استفاده از آن در تصفیه آب مزایای زیادی داشت چون احتیاج به مواد شیمیایی نبود و اثرات جانبی هم نداشتند.
اما زئولیت های سدیمی دارای محدودیت هایی بودند. این زئولیت ها می توانستند فقط سدیم را جایگزین کلسیم و منیزیم محلول در آب نمایند و آنیون هایی از قبیل سولفات، کلراید و سیلیکات ها بدون تغییر باقی می ماندند. چنین آبی برای صنایع مطلوب نیست. پس از انجام تحقیقات در اواسط دهه ۱۹۳۰ در هلند زئولیت هایی ساخته شد که به جای سدیم فعال، هیدروژن فعال داشتند. این زئولیت ها که به تعویض کننده های کاتیونی هیدروژنی معروف شدند، سیلیس نداشته و علاوه بر این قادرند همزمان هم سختی آب را حذف کنند و هم قلیائیت آب را کاهش دهند.

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفرزین های تبادل یونی به طور گسترده ای در فرایندهای جداسازی، تصفیه و ضدعفونی کردن استفاده می شود. شایع ترین کاربردهای آن رسوب زدایی و تصفیه آب است. در بسیاری از کاربردهای این چنینی، رزین های تبادل یونی به عنوان یک جایگزین انعطاف پذیرتر به جای استفاده از زئولیت های طبیعی یا مصنوعی معرفی شدند. همچنین رزین های تبادل یونی در فرایند فیلتراسیون بیودیزل بسیار کاربردی هستند. [ ۲]
پدیده تبادل یون برای اولین بار در سال ۱۸۵۰ و به دنبال مشاهده توانایی خاک های زراعی در تعویض برخی از یون ها مثل آمونیوم با یون کلسیم و منیزم موجود در ساختمان آنها گزارش شد. در سال ۱۸۷۰ با انجام آزمایش های متعددی ثابت شد که بعضی از کانی های طبیعی به خصوص زئولیت ها واجد توانایی انجام تبادل یون هستند. در واقع به رزین های معدنی، زئولیت می گویند و این مواد یون های سختی آور آب ( کلسیم و منیزیم ) را حذف می کردند و به جای آن یون سدیم، آزاد می کردند از این رو به زئولیت های سدیمی مشهور شدند که استفاده از آن در تصفیه آب مزایای زیادی داشت چون احتیاج به مواد شیمیایی نبود و اثرات جانبی هم نداشتند.
اما زئولیت های سدیمی دارای محدودیت هایی بودند. این زئولیت ها می توانستند فقط سدیم را جایگزین کلسیم و منیزیم محلول در آب نمایند و آنیون هایی از قبیل سولفات، کلراید و سیلیکات ها بدون تغییر باقی می ماندند. چنین آبی برای صنایع مطلوب نیست. پس از انجام تحقیقات در اواسط دهه ۱۹۳۰ در هلند زئولیت هایی ساخته شد که به جای سدیم فعال، هیدروژن فعال داشتند. این زئولیت ها که به تعویض کننده های کاتیونی هیدروژنی معروف شدند، سیلیس نداشته و علاوه بر این قادرند همزمان هم سختی آب را حذف کنند و هم قلیائیت آب را کاهش دهند.



wiki: رزین تبادل یونی
