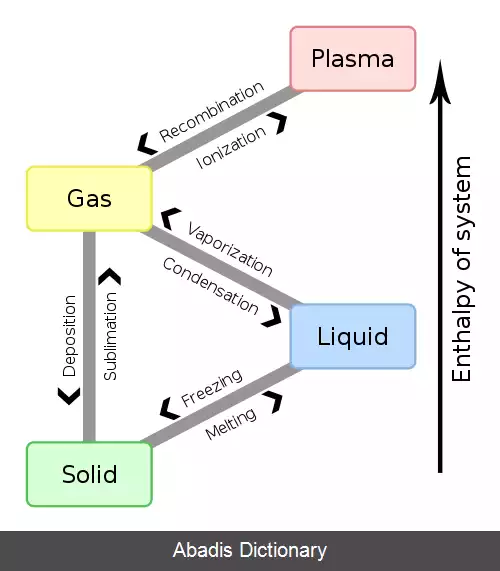
تصعید یا والایش[ ۱] ( به انگلیسی: Sublimation ) به تغییر
حالتِ ماده ای از جامد به گاز گفته می شود. در این تغییر حالت، ماده به حالت واسط
مایع در نمی آید. از نمونه های آشنا برای تصعید می توان تبدیل
نفتالین به گاز و تبدیل
برف به بخار را نام برد. [ ۲] چگالش، فرایند معکوس تصعید است که در آن، ماده به طور مستقیم از گاز به جامد تبدیل می شود.
بسیاری از بُن پارها و چندساخت های شیمیایی در فشار معمولی و در دماهای گوناگون در یکی از سه حالت جامد، مایع یا گاز یافت می شوند؛ همچنین گذرش از جامدی به گازی بیشتر همراه با گذرش به حالت میانی مایع است ( فشار در این جا فشار پاری ماده است و نه فشار سامانه ( برای نمونه فشار هواسپهری ) ) . از همین روی، بیشتر جامدهایی که دارای فشاری بالا باشند در دمایی ویژه می توانند از جامد به گاز بگذرند. برخی بن پارها مانند
کربن و
آرسنیک دارای فشار نقطهٔ سه تایی بسیار بالایی هستند و حالت مایع آن ها کمتر یافت می شوند. از این روی، فرازش برای این بن پارها بیشتر از بخارش روی می دهد.
تصعید به گذرش حالت گفته می شود و نه به ترادیسی از جامدی به گازی طی یک واکنشی شیمیایی. برای نمونه،
سوختن شمع مومی ( موم
پارافینی ) و تبدیل به
کربن دی اکسید و
بخار آب تصعید نیست، بلکه یک واکنش شیمیایی با
اکسیژن است.
تصعید، دگرشدگی گرماگیر است و نیاز به
انرژی بیشتری دارد. می توان آنتالپیِ تصعید ( که گرمای تصعید نیز خوانده می شود ) را با جمع
آنتالپی ذوب و آنتالپی تبخیر، به دست آورد.
آنتالپی مولی تصعید، مقدار
گرمایی است که بایستی به یک
مول از جامد داده شود تا یک راست به گاز تبدیل شود.
مولکول ها در یک بلور، پیرامون محور خود در شبکه می جنبند. پخش
انرژی جنبشی میان این
مولکول ها مانند پخش انرژی جنبشی میان مولکول های مایع و گاز است. در یک بلور، انرژی از مولکولی به مولکول دیگر رفته و از این رو انرژی هیچ مولکولی پایدار نیست. مولکول های پرانرژی در رویهٔ
بلور می توانند بر نیروهای جاذبهٔ بلور چیره شده، به حالت بخار تبدیل شوند.
اگر بلور در یک ظرف سربسته باشد، سرانجام
حالت تعادلی برقرار می شود که در آن حالت، سرعت جدا شدن
مولکول ها از جامد با سرعت بازگشت مولکول های بخار به بلور برابری می کند.
فشار بخار یک جامد در دمای معین، معیاری از تعداد مولکول ها در حجم معینی از بخار در حالت تعادل است.