گاز آرمانی[ ۱] یا گاز ایده آل ( به انگلیسی: Ideal gas ) گازی است که فقط در تئوری وجود دارد و شامل تعداد زیادی ذرات نقطه ای متحرک است که تنها برهم کنش آنها برخودهای کاملاً الاستیک است. مفهوم گاز ایده آل بسیار کاربردی است چرا که از قانون گاز ایده آل پیروی می کند. قانون گاز ایده آل یک معادله حالت ساده است و برای استفاده در مکانیک آماری مناسب است. [ ۲]
در بسیاری از شرایط عادی، رفتار بسیاری از گازهای واقعی از نظر کیفی بسیار شبیه به گاز ایده آل است. بسیاری از گازها از قبیل نیتروژن، اکسیژن، هیدروژن و گازهای نجیب و همچنین برخی گازهای سنگین تر از قبیل کربن دی اکسید را می توان تا دقت های بالایی گاز ایده آل فرض کرد. [ ۳] به صورت کلی گازها هر چه دمای بیشتر و فشار کمتری داشته باشند به گاز ایده آل نزدیک تر خواهند بود. [ ۳] در دماهای پایین و فشارهای بالا، نیروهای بین مولکولی و فاصله ها تاثیرگذارتر بوده و در نتیجه اگر گاز را گاز ایده آل در نظر بگیریم خطای زیادی خواهیم داشت، مانند بسیاری از مبردها یا گازهایی که نیروهای بین مولکولی قوی دارند؛ مانند بخار آب.
گازهای ایده آل در حالت تعادل داخلی از معادلهٔ گاز ایده آل پیروی می کنند:
که در آن P فشار داخلی مجموعه، V حجم مجموعه، n تعداد مول های ذرات مجموعه، R ثابت جهانی گازها و T دمای مجموعه با یکای کلوین است.
برای اثبات این قانون، اول لازم است که با قانون های بویل و شارل آشنا شویم.
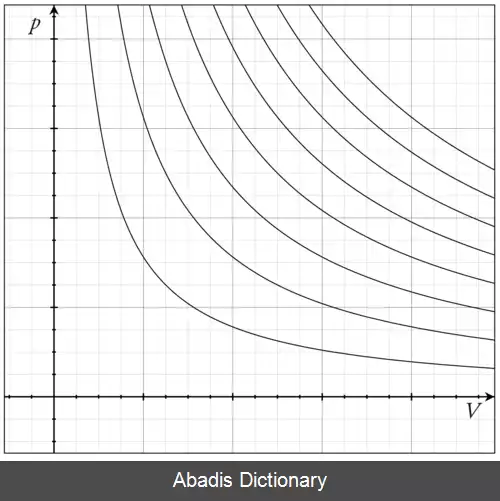
رابطهٔ بین فشار و حجم یک گاز در ۱۶۶۲ میلادی توسط رابرت بویل ( Robert Boyle ) اندازه گیری شد. بویل متوجه شد که افزایش فشار وارد شده بر یک گاز با کاهش حجم آن متناسب است. اگر فشار دو برابر شود، حجم به نصف کاهش می یابد. اگر فشار سه برابر شود، حجم به یک سوم حجم اولیه اش می رسد. قانون بویل می گوید که در دمای ثابت، حجم گاز با فشار رابطهٔ عکس دارد:
رابطهٔ بین حجم و دمای یک گاز در ۱۷۸۷ میلادی توسط ژاک شارل ( Jacques Charles ) مطالعه شد و نتایج او به طور قابل ملاحظه ای توسط شاگردانش ژوزف گیلوساک ( Joseph Gay - Lussac ) گسترش یافت. براساس این قانون حجم تمام گازها، در فشار ثابت، با دمای مطلق آن گاز رابطهٔ مستقیم دارد:
در دما و فشار ثابت حجم یک گاز با تعداد مول های آن نسبت مستقیم دارد. حجم یک مول گاز نصف حجم اشغال شده توسط ۲ مول گاز می باشد؛ بنابراین قانون و قوانین بویل و شارل می توان گفت که:
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر بسیاری از شرایط عادی، رفتار بسیاری از گازهای واقعی از نظر کیفی بسیار شبیه به گاز ایده آل است. بسیاری از گازها از قبیل نیتروژن، اکسیژن، هیدروژن و گازهای نجیب و همچنین برخی گازهای سنگین تر از قبیل کربن دی اکسید را می توان تا دقت های بالایی گاز ایده آل فرض کرد. [ ۳] به صورت کلی گازها هر چه دمای بیشتر و فشار کمتری داشته باشند به گاز ایده آل نزدیک تر خواهند بود. [ ۳] در دماهای پایین و فشارهای بالا، نیروهای بین مولکولی و فاصله ها تاثیرگذارتر بوده و در نتیجه اگر گاز را گاز ایده آل در نظر بگیریم خطای زیادی خواهیم داشت، مانند بسیاری از مبردها یا گازهایی که نیروهای بین مولکولی قوی دارند؛ مانند بخار آب.
گازهای ایده آل در حالت تعادل داخلی از معادلهٔ گاز ایده آل پیروی می کنند:
که در آن P فشار داخلی مجموعه، V حجم مجموعه، n تعداد مول های ذرات مجموعه، R ثابت جهانی گازها و T دمای مجموعه با یکای کلوین است.
برای اثبات این قانون، اول لازم است که با قانون های بویل و شارل آشنا شویم.
رابطهٔ بین فشار و حجم یک گاز در ۱۶۶۲ میلادی توسط رابرت بویل ( Robert Boyle ) اندازه گیری شد. بویل متوجه شد که افزایش فشار وارد شده بر یک گاز با کاهش حجم آن متناسب است. اگر فشار دو برابر شود، حجم به نصف کاهش می یابد. اگر فشار سه برابر شود، حجم به یک سوم حجم اولیه اش می رسد. قانون بویل می گوید که در دمای ثابت، حجم گاز با فشار رابطهٔ عکس دارد:
رابطهٔ بین حجم و دمای یک گاز در ۱۷۸۷ میلادی توسط ژاک شارل ( Jacques Charles ) مطالعه شد و نتایج او به طور قابل ملاحظه ای توسط شاگردانش ژوزف گیلوساک ( Joseph Gay - Lussac ) گسترش یافت. براساس این قانون حجم تمام گازها، در فشار ثابت، با دمای مطلق آن گاز رابطهٔ مستقیم دارد:
در دما و فشار ثابت حجم یک گاز با تعداد مول های آن نسبت مستقیم دارد. حجم یک مول گاز نصف حجم اشغال شده توسط ۲ مول گاز می باشد؛ بنابراین قانون و قوانین بویل و شارل می توان گفت که:


wiki: گاز ایدئال
