کلرات
/kolorAt/
معنی انگلیسی:
لغت نامه دهخدا
- کلرات دوپتاس ؛ ملح پتاسیم اسید کلریک ( Clo3H )است و فرمولش Clo3K می باشد.این نمک به عنوان ضدعفونی کردن حلق و گلو و ضایعات مخاط دهان در دندان پزشکی مورد استعمال دارد و بعلاوه در شیمی بعنوان یکی از اکسیدکننده های قوی بکار می رود. نمکی است سفید رنگ و قابل حل در آب و به مقدار بالغ بر 15 گرم مسموم کننده و کشنده است. چون بسهولت در برابر کمی گرما و یا ضربه مختصر، اکسیژن خود را از دست می دهد، لذا جهت ساختن ترقه ها و چاشنیها مصرف می شود. ( فرهنگ فارسی معین ).
فرهنگ فارسی
فرهنگ معین
فرهنگ عمید
دانشنامه عمومی
آنیون کلرات، به ساختار شیمیایی ClO۳− گفته می شود همچنین به ترکیباتی که در آن ها این یون وجود داشته باشد نیز کلرات گفته می شود. عدد اکسایش کلر ۵+ است. کلرات ها نمک های اسید کلریک اند. هنگامی که از یک عدد رومی در کنار نام کلرات استفاده شود برای اشاره به گونه ای، اکسی آنیون کلر بوده است.
بر پایهٔ نظریهٔ دافعهٔ زوج الکترون لایهٔ ظرفیتی، آنیون کلرات باید ساختار هرمی سه بعدی داشته باشد. کلرات ها، اکسیدکننده های قوی اند و باید آن ها را از مواد آلی یا موادی که به آسانی دچار اکسایش می شوند دور نگه داشت.
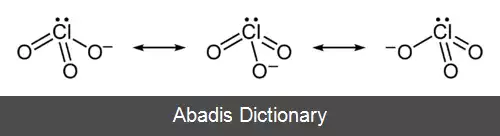
یون کلرات را نمی توان با یک ساختار لوویس نمایش داد چون همهٔ پیوندهای Cl - O دارای یک طول اند ( ۱٫۴۹ آنگستروم در پتاسیم کلرات[ ۱] ) و اتم کلر اتمی با تعداد بالای الکترون لایه ظرفیت است.
کلرات فلزها را می توان با افزودن کلر به هیدروکسید داغ فلز مانند هیدروکسید پتاسیم بدست آورد:
در اینجا واکنش تسهیم نامتناسب داریم که در آن کلر با عدد اکسایش صفر، کلرید با عدد اکسایش ۱ - و کلرات با عدد اکسایش ۵+ را پدید می آورد. از واکنش هیدروکسید سرد آبدار فلز، کلرید و هیپوکلریت بدست می آید.
تولید صنعتی کلرات سدیم به جای گاز کلر، از محلول کلرید سدیم آبدار آغاز می شود. اگر ابزارهای الکترولیز امکان ترکیب کلر و سدیم هیدروکسید را بدهد آنگاه واکنش تسهیم نامتناسب توضیح داده شده در بالا روی می دهد. گرمادهی ۵۰ تا ۷۰ درجه ای به واکنش دهنده ها بوسیلهٔ توان الکتریکی بکار رفته در برق کافت صورت می گیرد. [ نیازمند منبع]
پژوهش ها نشان داده است که رسوب های کلرات در مناطق خشک زمین با غلظت بالا پیدا می شود. [ ۲] همچنین در نمونه های باران هم یون کلرات دیده شده است که مقدار آن با پرکلرات برابر بوده است؛ به همین دلیل گمان آن می رود که کلرات و پرکلرات باید سرچشمهٔ پیدایش مشابهی در طبیعت داشته باشند و این می تواند بخشی از چرخهٔ کلر در شیمی زمین باشد. اندامک هایی وجود دارند که می توانند کلرات را دچار کاهش به کلرید کنند. [ ۳]
موارد زیر از جمله کلرات ها است:
• پتاسیم کلرات KClO۳
• سدیم کلرات NaClO۳
• منیزیم کلرات Mg ( ClO۳ ) ۲
اگر یک عدد رومی در پرانتز کنار نام کلرات باشد به این معنی است که اکسی آنیون دارای کلر با عدد اکسایش گفته شده دارد. برای نمونه:
در اینجا نام «کلرات» به معنی هر اکسی آنیون کلر است اما معمولاً عبارت «کلرات» برای اشاره به کلرهای با عدد اکسایش ۵+ است.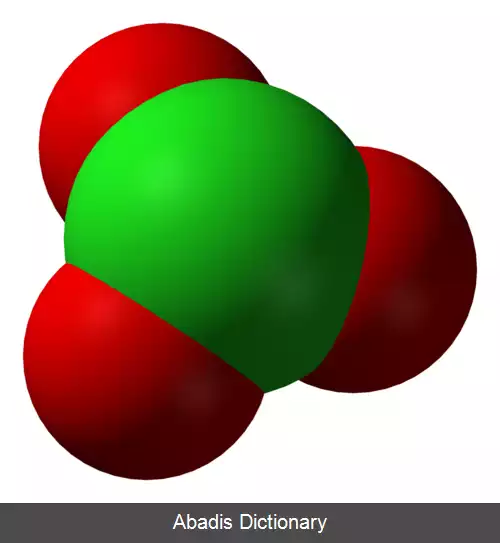
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفبر پایهٔ نظریهٔ دافعهٔ زوج الکترون لایهٔ ظرفیتی، آنیون کلرات باید ساختار هرمی سه بعدی داشته باشد. کلرات ها، اکسیدکننده های قوی اند و باید آن ها را از مواد آلی یا موادی که به آسانی دچار اکسایش می شوند دور نگه داشت.
یون کلرات را نمی توان با یک ساختار لوویس نمایش داد چون همهٔ پیوندهای Cl - O دارای یک طول اند ( ۱٫۴۹ آنگستروم در پتاسیم کلرات[ ۱] ) و اتم کلر اتمی با تعداد بالای الکترون لایه ظرفیت است.
کلرات فلزها را می توان با افزودن کلر به هیدروکسید داغ فلز مانند هیدروکسید پتاسیم بدست آورد:
در اینجا واکنش تسهیم نامتناسب داریم که در آن کلر با عدد اکسایش صفر، کلرید با عدد اکسایش ۱ - و کلرات با عدد اکسایش ۵+ را پدید می آورد. از واکنش هیدروکسید سرد آبدار فلز، کلرید و هیپوکلریت بدست می آید.
تولید صنعتی کلرات سدیم به جای گاز کلر، از محلول کلرید سدیم آبدار آغاز می شود. اگر ابزارهای الکترولیز امکان ترکیب کلر و سدیم هیدروکسید را بدهد آنگاه واکنش تسهیم نامتناسب توضیح داده شده در بالا روی می دهد. گرمادهی ۵۰ تا ۷۰ درجه ای به واکنش دهنده ها بوسیلهٔ توان الکتریکی بکار رفته در برق کافت صورت می گیرد. [ نیازمند منبع]
پژوهش ها نشان داده است که رسوب های کلرات در مناطق خشک زمین با غلظت بالا پیدا می شود. [ ۲] همچنین در نمونه های باران هم یون کلرات دیده شده است که مقدار آن با پرکلرات برابر بوده است؛ به همین دلیل گمان آن می رود که کلرات و پرکلرات باید سرچشمهٔ پیدایش مشابهی در طبیعت داشته باشند و این می تواند بخشی از چرخهٔ کلر در شیمی زمین باشد. اندامک هایی وجود دارند که می توانند کلرات را دچار کاهش به کلرید کنند. [ ۳]
موارد زیر از جمله کلرات ها است:
• پتاسیم کلرات KClO۳
• سدیم کلرات NaClO۳
• منیزیم کلرات Mg ( ClO۳ ) ۲
اگر یک عدد رومی در پرانتز کنار نام کلرات باشد به این معنی است که اکسی آنیون دارای کلر با عدد اکسایش گفته شده دارد. برای نمونه:
در اینجا نام «کلرات» به معنی هر اکسی آنیون کلر است اما معمولاً عبارت «کلرات» برای اشاره به کلرهای با عدد اکسایش ۵+ است.



wiki: کلرات
دانشنامه آزاد فارسی
کُلُرات (chlorate)
نمک های حاصل از اسید، دارای اتم های کلر و اکسیژن، و یون های منفی ClO-۴ ،ClO-۳ ،ClO-۲ ،ClO-. کلرات های سدیم، پتاسیم و باریوم از کلرات های متداول اند. برخی از کلرات ها در علف کش ها به کار می روند.
نمک های حاصل از اسید، دارای اتم های کلر و اکسیژن، و یون های منفی ClO-۴ ،ClO-۳ ،ClO-۲ ،ClO-. کلرات های سدیم، پتاسیم و باریوم از کلرات های متداول اند. برخی از کلرات ها در علف کش ها به کار می روند.
wikijoo: کلرات
مترادف ها
کلرات، نمک اسید کلریک
پیشنهاد کاربران
پیشنهادی ثبت نشده است. شما اولین نفر باشید
