ژن درمانی
/ZendarmAni/
فرهنگ معین
فرهنگستان زبان و ادب
دانشنامه عمومی
منظور از ژن درمانی مجموعه ای از روش های درمانی است که طی آن با ترمیم و رفع عیب ژن، بیماری را درمان می کنند.
در گذشته تمام اقسام ژن درمانی متکی به نوعی ناقل ( وکتور ) برای انتقال عامل درمان به درون سلول بودند[ ۱] اما در حال حاضر شیوه های دیگری نیز عرضه گردیده اند. [ ۲] [ ۳] نخستین عمل بالینی ژن درمانی در سال ۱۹۹۰ توسط موسسات ملی بهداشت ایالات متحده آمریکا انجام گرفت.
ژن ها که بر روی کرموزوم ها قرار دارند، واحدهای فیزیکی و کارکردی پایه ای بدن هستند. ژن ها توالی های اختصاصی بازهایی هستند که چگونگی ساخت پروتئین ها را رمزبندی می کنند. گرچه ژن ها بیشتر مورد توجه قرار می گیرند، اما این پروتئین ها هستند که اغلب کارکردهای حیاتی را انجام می دهند و حتی اکثریت ساختارهای سلولی را تشکیل می دهند. هنگامی که ژن ها به نحوی تغییر پیدا کنند که پروتئین های رمزبندی شده به وسیلهٔ آن ها نتوانند کارکردهای طبیعی شان را انجام دهند، بیماری های ژنتیکی به وجود می آیند. ژن درمانی تکنیکی است برای تصحیح ژن های معیوبی که مسئول ایجاد بیماری هستند. پژوهشگران ممکن است یکی از چندین رویکرد موجود را برای تصحیح ژن های معیوب به کار ببندند. ژن طبیعی ممکن است به درون یک محل غیراختصاصی درون ژنوم کاشته شود تا یک ژن بی کارکرد را جایگزین کند. این روش یک رویکرد رایج است. یک رویکرد دیگر تعویض ژن غیرطبیعی از طریق «بازترکیبی هومولوگ» است. ژن غیرطبیعی را می توان از طریق «جهش معکوس انتخابی» ترمیم کرد، که باعث می شود، ژن به کارکرد طبیعی اش بازگردد. تنظیم یک ژن خاص ( میزانی را که یک ژن خاموش و روشن می شود ) را نیز می توان تغییر داد.
در اغلب بررسی های ژن درمانی، ژن «طبیعی» به درون ژنوم وارد می شود تا جایگزین یک ژن بیماری زای «غیرطبیعی» شود. یک مولکول حامل که به آن ناقل ( vector ) می گویند، برای وارد کردن ژن درمان کننده به سلول های هدف بیمار مورد استفاده قرار می گیرد.
در حال حاضر رایج ترین ناقل مورد استفاده ویروسی است که به طور ژنتیکی تغییر داده شده است، تا DNA طبیعی انسانی را حمل کند. ویروس ها طوری تکامل یافته اند تا ژن های شان را به شیوه ای آسیب زا به درون سلول های انسانی وارد کنند. دانشمندان سعی کرده اند تا از این توانایی ویروس ها سود ببرند و ژنوم ویروس ها را طوری دستکاری کنند که ژن های بیماری زا را از سلول حذف و ژن های درمان کننده را وارد آن کنند. سلول های هدف مثلاً سلول های کبد یا ریه بیمار با ناقل ویروسی آلوده می شوند. پروتئین های جدید دارای کارکرد که به وسیلهٔ ژن درمان کننده ایجاد می شوند، سلول را به وضعیت طبیعی بازمی گردانند. به غیر از ویروس ها، گزینه های دیگری برای وارد کردن ژن ها به درون سلول ها وجود دارد.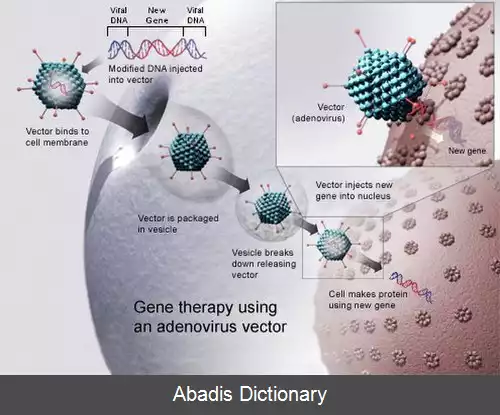
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر گذشته تمام اقسام ژن درمانی متکی به نوعی ناقل ( وکتور ) برای انتقال عامل درمان به درون سلول بودند[ ۱] اما در حال حاضر شیوه های دیگری نیز عرضه گردیده اند. [ ۲] [ ۳] نخستین عمل بالینی ژن درمانی در سال ۱۹۹۰ توسط موسسات ملی بهداشت ایالات متحده آمریکا انجام گرفت.
ژن ها که بر روی کرموزوم ها قرار دارند، واحدهای فیزیکی و کارکردی پایه ای بدن هستند. ژن ها توالی های اختصاصی بازهایی هستند که چگونگی ساخت پروتئین ها را رمزبندی می کنند. گرچه ژن ها بیشتر مورد توجه قرار می گیرند، اما این پروتئین ها هستند که اغلب کارکردهای حیاتی را انجام می دهند و حتی اکثریت ساختارهای سلولی را تشکیل می دهند. هنگامی که ژن ها به نحوی تغییر پیدا کنند که پروتئین های رمزبندی شده به وسیلهٔ آن ها نتوانند کارکردهای طبیعی شان را انجام دهند، بیماری های ژنتیکی به وجود می آیند. ژن درمانی تکنیکی است برای تصحیح ژن های معیوبی که مسئول ایجاد بیماری هستند. پژوهشگران ممکن است یکی از چندین رویکرد موجود را برای تصحیح ژن های معیوب به کار ببندند. ژن طبیعی ممکن است به درون یک محل غیراختصاصی درون ژنوم کاشته شود تا یک ژن بی کارکرد را جایگزین کند. این روش یک رویکرد رایج است. یک رویکرد دیگر تعویض ژن غیرطبیعی از طریق «بازترکیبی هومولوگ» است. ژن غیرطبیعی را می توان از طریق «جهش معکوس انتخابی» ترمیم کرد، که باعث می شود، ژن به کارکرد طبیعی اش بازگردد. تنظیم یک ژن خاص ( میزانی را که یک ژن خاموش و روشن می شود ) را نیز می توان تغییر داد.
در اغلب بررسی های ژن درمانی، ژن «طبیعی» به درون ژنوم وارد می شود تا جایگزین یک ژن بیماری زای «غیرطبیعی» شود. یک مولکول حامل که به آن ناقل ( vector ) می گویند، برای وارد کردن ژن درمان کننده به سلول های هدف بیمار مورد استفاده قرار می گیرد.
در حال حاضر رایج ترین ناقل مورد استفاده ویروسی است که به طور ژنتیکی تغییر داده شده است، تا DNA طبیعی انسانی را حمل کند. ویروس ها طوری تکامل یافته اند تا ژن های شان را به شیوه ای آسیب زا به درون سلول های انسانی وارد کنند. دانشمندان سعی کرده اند تا از این توانایی ویروس ها سود ببرند و ژنوم ویروس ها را طوری دستکاری کنند که ژن های بیماری زا را از سلول حذف و ژن های درمان کننده را وارد آن کنند. سلول های هدف مثلاً سلول های کبد یا ریه بیمار با ناقل ویروسی آلوده می شوند. پروتئین های جدید دارای کارکرد که به وسیلهٔ ژن درمان کننده ایجاد می شوند، سلول را به وضعیت طبیعی بازمی گردانند. به غیر از ویروس ها، گزینه های دیگری برای وارد کردن ژن ها به درون سلول ها وجود دارد.

wiki: ژن درمانی
دانشنامه آزاد فارسی
ژِن درمانی (gene therapy)
ژِن درمانی
نوعی روش پزشکی، برای درمان یا برطرف کردن بیماری ها یا نقایص ارثی ناشی از عملکرد نادرست ژن ها، برخی از عفونت ها، و چندین نوع سرطان. در این روش، یاخته های درگیر از بدن بیمار گرفته می شوند، دی ان اِی آن ها در آزمایشگاه ترمیم می شود (مهندسی ژنتیک)، و یاخته هایی که فعالیت طبیعی خود را به دست آورده اند، مجدداً به بدن بازگردانده می شوند. در ۱۹۹۰، برای اولین بار از یک ژن دست کاری شده برای درمان بیماری استفاده شد. در ۱۹۹۰، یک دختر امریکایی چهارساله، از بچه های معروف به بچه های حبابی، برای نخستین بار ژن درمانی شد. این دختر مبتلا به کمبود آنزیم آدنوزین دِآمینازبود. این بیماری نوعی کمبود آنزیمی نادر است که باعث ضعف دستگاه ایمنی در مبارزه با عفونت ها می شود، لذا این کودکان را باید در حباب های عاری از میکروب بزرگ کرد و معمولاً در سنین پایین می میرند (← نقص_ایمنی_شدید_مرکب). فیبروز کیستیکاز شایع ترین بیماری های ارثی و ازجمله بیماری هایی است که مهندسان ژنتیک بیش از بقیه به آن توجه کرده اند. امریکا و انگلستان در درمان این بیماری پیشگام بوده اند. ژن درمانی راه حل نهایی برای بیماری های ارثی نیست. این روش ممکن است بیمار را درمان کند، ولی مانع از انتقال نقص وراثتی به فرزندان او نمی شود. با این همه، ممکن است از این روش در درمان بیماری های دیگر، ازجمله بیماری های قلبی و برخی از سرطان ها، استفاده کرد. پژوهشگران امریکایی توانسته اند با تفنگ ژنیبه شکل موفقیت آمیزی گروه خاصی از یاخته های بدخیم را هدف قرار دهند. در اواخر دهۀ ۱۹۹۰، با آن که صدها نفر ژن درمانی شده بودند، هیچ یک بهبودی نیافتند. حتی در کارآزمایی های کمبود آدنوزین دِآمیناز، که ژن درمانی برای درمان آن موفقیت بیشتری داشته است، هنور به کودکان آدنوزین دِآمیناز مصنوعی تزریق می شد و احتمالاً بخش عمدۀ بهبودی آن ها ناشی از تزریق ها بود. مرگ نوجوانی امریکایی، با نام جسی گلسینگر، حین کارآزمایی بالینی در ۱۹۹۹ مانع بزرگی در راه به کارگیری این روش برای درمان بیماران شد. در ۱۹۹۳، پژوهشگران توانستند با ژن درمانی عملکرد طبیعی یاخته های شش موش هایی را که به صورت مصنوعی به فیبروز کیستیک مبتلا شده بودند، بازگردانند. این موفقیت امید دستیابی به چنین روشی را برای درمان انسان ها افزایش داد. درحال حاضر از رترو ویروس ها به منزلۀ حاملاستفاده می کنند، ولی از آن جا که با این ویروس ها نمی توان بخش خاصی از کروموزوم را هدف قرار داد، آزمایش هایی برای استفاده از دو نوع ویروس، آدنوویروسو ویروس همراه آدنو، درحال اجراست. با استفاده از آدنوویروس نقص فیبروز کیستیک در حفرۀ بینی با موفقیت اصلاح شده است. ویروس همراه آدنو از این نظر که محمولۀ ژنیخود را در ناحیه ای خاص قرار می دهد و در انسان موجب بیماری نمی شود، اهمیت دارد. برخی از شرکت هایی که در زمینۀ فناوری زیستیفعالیت می کنند، از ویروس ها استفاده نمی کنند. زیرا اعتقاد دارند که برخی از یاخته ها دی اِن اِی را پس از تزریق به بدن جذب و طبق آن عمل می کنند و پژوهش ها بر این اساس صورت می گیرد. استفاده از ناقل های لیپوزومیبرای واردکردن دی اِن اِی جدید یا تغییریافته به یاخته روشی بی خطر، ولی کم دقت است، زیرا این ناقل ها محمولۀ خود را به صورت یکسان به همۀ یاخته ها، هدف و غیرهدف، وارد می کنند. ویروس های ناتوان شده دقیق تر عمل می کنند، ولی ممکن است بار دیگر فعال و موجب بیماری شوند. به همین سبب، استفاده از آن ها با مخاطراتی همراه است. در ۱۹۹۵، پژوهش هایی برای دستیابی به نوعی ناقل دقیق و بی خطر با استفاده از گروهی از ژن ها، با نام ناحیۀ کنترل لوکوسیا ال سی آر شروع شد. در این پژوهش ها، ژن درمان کننده به اِل سی آر متصل می شود. اِل سی آر بعد از ورود به یاخته و زمانی فعال می شود که با پروتئین های مخصوصِ یاخته های هدفِ ژن درمان کننده تماس پیدا کند. در ۱۹۹۶، تلاش هایی برای درمان سرطان ریه در امریکا صورت گرفت که با موفقیت همراه بود. در نُه بیمار، که سرطانشان عود کرده بود، ژن پ ۵۳ که در بیش از ۵۰ درصد از سرطان ها جهش یافته یا ازدست رفته است، مستقیماً به تومور تزریق شد. درپی تزریق، تومور در سه بیمار کوچک و رشد آن در سه بیمار دیگر متوقف شد.
ژِن درمانی
نوعی روش پزشکی، برای درمان یا برطرف کردن بیماری ها یا نقایص ارثی ناشی از عملکرد نادرست ژن ها، برخی از عفونت ها، و چندین نوع سرطان. در این روش، یاخته های درگیر از بدن بیمار گرفته می شوند، دی ان اِی آن ها در آزمایشگاه ترمیم می شود (مهندسی ژنتیک)، و یاخته هایی که فعالیت طبیعی خود را به دست آورده اند، مجدداً به بدن بازگردانده می شوند. در ۱۹۹۰، برای اولین بار از یک ژن دست کاری شده برای درمان بیماری استفاده شد. در ۱۹۹۰، یک دختر امریکایی چهارساله، از بچه های معروف به بچه های حبابی، برای نخستین بار ژن درمانی شد. این دختر مبتلا به کمبود آنزیم آدنوزین دِآمینازبود. این بیماری نوعی کمبود آنزیمی نادر است که باعث ضعف دستگاه ایمنی در مبارزه با عفونت ها می شود، لذا این کودکان را باید در حباب های عاری از میکروب بزرگ کرد و معمولاً در سنین پایین می میرند (← نقص_ایمنی_شدید_مرکب). فیبروز کیستیکاز شایع ترین بیماری های ارثی و ازجمله بیماری هایی است که مهندسان ژنتیک بیش از بقیه به آن توجه کرده اند. امریکا و انگلستان در درمان این بیماری پیشگام بوده اند. ژن درمانی راه حل نهایی برای بیماری های ارثی نیست. این روش ممکن است بیمار را درمان کند، ولی مانع از انتقال نقص وراثتی به فرزندان او نمی شود. با این همه، ممکن است از این روش در درمان بیماری های دیگر، ازجمله بیماری های قلبی و برخی از سرطان ها، استفاده کرد. پژوهشگران امریکایی توانسته اند با تفنگ ژنیبه شکل موفقیت آمیزی گروه خاصی از یاخته های بدخیم را هدف قرار دهند. در اواخر دهۀ ۱۹۹۰، با آن که صدها نفر ژن درمانی شده بودند، هیچ یک بهبودی نیافتند. حتی در کارآزمایی های کمبود آدنوزین دِآمیناز، که ژن درمانی برای درمان آن موفقیت بیشتری داشته است، هنور به کودکان آدنوزین دِآمیناز مصنوعی تزریق می شد و احتمالاً بخش عمدۀ بهبودی آن ها ناشی از تزریق ها بود. مرگ نوجوانی امریکایی، با نام جسی گلسینگر، حین کارآزمایی بالینی در ۱۹۹۹ مانع بزرگی در راه به کارگیری این روش برای درمان بیماران شد. در ۱۹۹۳، پژوهشگران توانستند با ژن درمانی عملکرد طبیعی یاخته های شش موش هایی را که به صورت مصنوعی به فیبروز کیستیک مبتلا شده بودند، بازگردانند. این موفقیت امید دستیابی به چنین روشی را برای درمان انسان ها افزایش داد. درحال حاضر از رترو ویروس ها به منزلۀ حاملاستفاده می کنند، ولی از آن جا که با این ویروس ها نمی توان بخش خاصی از کروموزوم را هدف قرار داد، آزمایش هایی برای استفاده از دو نوع ویروس، آدنوویروسو ویروس همراه آدنو، درحال اجراست. با استفاده از آدنوویروس نقص فیبروز کیستیک در حفرۀ بینی با موفقیت اصلاح شده است. ویروس همراه آدنو از این نظر که محمولۀ ژنیخود را در ناحیه ای خاص قرار می دهد و در انسان موجب بیماری نمی شود، اهمیت دارد. برخی از شرکت هایی که در زمینۀ فناوری زیستیفعالیت می کنند، از ویروس ها استفاده نمی کنند. زیرا اعتقاد دارند که برخی از یاخته ها دی اِن اِی را پس از تزریق به بدن جذب و طبق آن عمل می کنند و پژوهش ها بر این اساس صورت می گیرد. استفاده از ناقل های لیپوزومیبرای واردکردن دی اِن اِی جدید یا تغییریافته به یاخته روشی بی خطر، ولی کم دقت است، زیرا این ناقل ها محمولۀ خود را به صورت یکسان به همۀ یاخته ها، هدف و غیرهدف، وارد می کنند. ویروس های ناتوان شده دقیق تر عمل می کنند، ولی ممکن است بار دیگر فعال و موجب بیماری شوند. به همین سبب، استفاده از آن ها با مخاطراتی همراه است. در ۱۹۹۵، پژوهش هایی برای دستیابی به نوعی ناقل دقیق و بی خطر با استفاده از گروهی از ژن ها، با نام ناحیۀ کنترل لوکوسیا ال سی آر شروع شد. در این پژوهش ها، ژن درمان کننده به اِل سی آر متصل می شود. اِل سی آر بعد از ورود به یاخته و زمانی فعال می شود که با پروتئین های مخصوصِ یاخته های هدفِ ژن درمان کننده تماس پیدا کند. در ۱۹۹۶، تلاش هایی برای درمان سرطان ریه در امریکا صورت گرفت که با موفقیت همراه بود. در نُه بیمار، که سرطانشان عود کرده بود، ژن پ ۵۳ که در بیش از ۵۰ درصد از سرطان ها جهش یافته یا ازدست رفته است، مستقیماً به تومور تزریق شد. درپی تزریق، تومور در سه بیمار کوچک و رشد آن در سه بیمار دیگر متوقف شد.
wikijoo: ژن_درمانی
پیشنهاد کاربران
پیشنهادی ثبت نشده است. شما اولین نفر باشید
