پیل الکتروشیمیایی ( به انگلیسی: Electrochemical cell ) پیلی است که در آن در اثر واکنش شیمیایی، جریان الکتریکی تولید می شود یا واکنشی شیمیایی بوسیله انرژی الکتریکی انجام می شود. باتری های ۵/۱ ولت معمولی نمونه ای از یک پیل الکتروشیمیایی اند. ( گرچه که به بیان درست تر یک پیل گالوانیکاند. )
پیل الکتروشیمیایی چهار بخش دارد:
آند: که در آن واکنش آندی رخ می دهد.
کاتد: که در ان واکنش کاتدی رخ می دهد. کاتد بخشی از سطح است که هدایت الکتریکی اش بالا باشد وقابلیت انجام واکنش آن بالا باشد. برای مثال در چدن خاکستری گرافیتهای سطح کاتداند.
الکترولیت: که برای رخ دادن واکنش بین آند و کاتد است و باید هدایت الکتریکی اش بالا باشد. الکترولیت می تواند محلول ۰۰۰۱/۰ نمک خوراکی یا محلول نمکین آب دریا باشد.
پل: که بین آند و کاتد اتصال الکتریکی برای جابجایی الکترون برقرار می کند.
در پیل الکتروشیمیایی بایستی سرعت زایش و گیرش الکترون برابر باشد.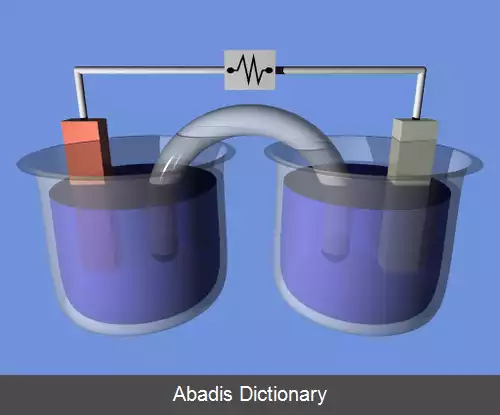
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفپیل الکتروشیمیایی چهار بخش دارد:
آند: که در آن واکنش آندی رخ می دهد.
کاتد: که در ان واکنش کاتدی رخ می دهد. کاتد بخشی از سطح است که هدایت الکتریکی اش بالا باشد وقابلیت انجام واکنش آن بالا باشد. برای مثال در چدن خاکستری گرافیتهای سطح کاتداند.
الکترولیت: که برای رخ دادن واکنش بین آند و کاتد است و باید هدایت الکتریکی اش بالا باشد. الکترولیت می تواند محلول ۰۰۰۱/۰ نمک خوراکی یا محلول نمکین آب دریا باشد.
پل: که بین آند و کاتد اتصال الکتریکی برای جابجایی الکترون برقرار می کند.
در پیل الکتروشیمیایی بایستی سرعت زایش و گیرش الکترون برابر باشد.

wiki: پیل برق شیمیایی
