لغت نامه دهخدا
فرهنگ فارسی
فرهنگ معین
فرهنگ عمید
دانشنامه عمومی
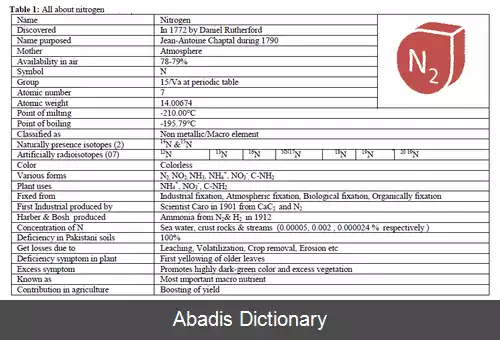
نیتروژِن ( به انگلیسی: Nitrogen ) یا اَزُت ( به فرانسوی: Azote ) یکی از عنصرهای شیمیایی در جدول تناوبی است که نشان شیمیایی آن N و عدد اتمی آن ۷ است. نیتروژن معمولاً به صورت یک گاز، نافلز، دو اتمی بی اثر، بی رنگ، بی مزه و بی بو است که ۷۸٪ جو زمین را دربر گرفته و عنصر اصلی در بافت های زنده است. نیتروژن ترکیبات مهمی مانند آمونیاک، اسید نیتریک و سیانیدها را شکل می دهد.
گاز نیتروژن درصَد عمده ای از هوای اطراف ما را تشکیل می دهد. از گاز نیتروژن می توان به منظور کاهش یا از بین بردن اُکسایش ( اکسیداسیون ) مواد غذایی استفاده کرد.
نیتروژن از گروه غیرفلزات بوده و دارای بار الکترون منفی ۳٫۰ می باشد. نیتروژن پنج الکترون در پوسته خود داشته و در نتیجه در اکثر ترکیبات سه ظرفیتی است. نیتروژن خالص یک گاز بی اثر و بی رنگ است و ۷۸٪ جو زمین را به خود اختصاص داده است. در ۶۳K منجمد شده و در ۷۷K به صورت مایع، به مادهٔ سرمایشی معروف سرمازا ( Cryogen ) تبدیل می شود.
به طور کلی چرخه نیتروژن به زبان ساده عبارت است از: نیتروژنِ هوا به هنگام آذرخش به اکسید نیتروژن تبدیل شده و در باران حل شده و جذب خاک می شود؛ در خاک این ترکیبات، توسط باکتری ها به موادی تبدیل می شوند که به وسیله گیاهان جذب می شوند. حیوانات از جمله سگ هار و سگ پاچه گیرحیوانات با خوردن گیاهان، نیتروژن را وارد بدن خود می کنند، با مردن و تجزیه اندام حیوانات، دوباره نیتروژن وارد هوا می شود.
گیاهان با انجام عمل فتوسنتز باعث تولید اکسیژن، انرژی و گلوکز ( قند ساده ) می شوند؛ حال برای آنکه گیاه بتواند با کمک قند ساخته شده، پروتئین سازی کند، نیاز به نیتروژن دارد؛ اما نمی تواند این نیتروژن را به طور مستقیم از هوا دریافت کند، بلکه می بایست آن را به صورت یک ماده محلول درآب به نام نیترات توسط ریشه های خود جذب نماید.
مهم ترین کاربرد اقتصادی نیتروژن برای ساخت آمونیاک از طریق فرایند هابر ( Haber ) است. آمونیاک معمولاً برای تولید کود و مواد تقویتی و تولید اسید نیتریک استفاده می شود. نیتروژن همچنین به عنوان پرکننده بی اثر، در مخزن های بزرگ برای نگهداری مایعات قابل انفجار، و در هنگام ساخت قطعات الکترونیک مانند ترانزیستور، دیود و مدار یکپارچه و همچنین برای ساخت فلزات ضدزنگ استفاده می شود. نیتروژن همچنین به صورت ماده خنک کننده، هم برای منجمد کردن غذا و هم ترابری آن، نگهداری اجساد و یاخته های تناسلی ( اسپرم و تخمک ) و غده های جنسی ( بیضه و تخمدان ) ، و در زیست شناسی برای نگهداری پایدار از نمونه های زیستی کاربرد دارد. نمک اسید نیتریک شامل ترکیبات مهمی مانند نیترات پتاسیوم و سدیم و نیترات آمونیوم است؛ که اولی برای تولید باروت و دومی برای تولید کود به کار می رود. ترکیبات نیترات شده مانند نیتروگلیسرین و تری نیترو تولوئن ( تی ان تی ) معمولاً منفجر شونده هستند.




این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفگاز نیتروژن درصَد عمده ای از هوای اطراف ما را تشکیل می دهد. از گاز نیتروژن می توان به منظور کاهش یا از بین بردن اُکسایش ( اکسیداسیون ) مواد غذایی استفاده کرد.
نیتروژن از گروه غیرفلزات بوده و دارای بار الکترون منفی ۳٫۰ می باشد. نیتروژن پنج الکترون در پوسته خود داشته و در نتیجه در اکثر ترکیبات سه ظرفیتی است. نیتروژن خالص یک گاز بی اثر و بی رنگ است و ۷۸٪ جو زمین را به خود اختصاص داده است. در ۶۳K منجمد شده و در ۷۷K به صورت مایع، به مادهٔ سرمایشی معروف سرمازا ( Cryogen ) تبدیل می شود.
به طور کلی چرخه نیتروژن به زبان ساده عبارت است از: نیتروژنِ هوا به هنگام آذرخش به اکسید نیتروژن تبدیل شده و در باران حل شده و جذب خاک می شود؛ در خاک این ترکیبات، توسط باکتری ها به موادی تبدیل می شوند که به وسیله گیاهان جذب می شوند. حیوانات از جمله سگ هار و سگ پاچه گیرحیوانات با خوردن گیاهان، نیتروژن را وارد بدن خود می کنند، با مردن و تجزیه اندام حیوانات، دوباره نیتروژن وارد هوا می شود.
گیاهان با انجام عمل فتوسنتز باعث تولید اکسیژن، انرژی و گلوکز ( قند ساده ) می شوند؛ حال برای آنکه گیاه بتواند با کمک قند ساخته شده، پروتئین سازی کند، نیاز به نیتروژن دارد؛ اما نمی تواند این نیتروژن را به طور مستقیم از هوا دریافت کند، بلکه می بایست آن را به صورت یک ماده محلول درآب به نام نیترات توسط ریشه های خود جذب نماید.
مهم ترین کاربرد اقتصادی نیتروژن برای ساخت آمونیاک از طریق فرایند هابر ( Haber ) است. آمونیاک معمولاً برای تولید کود و مواد تقویتی و تولید اسید نیتریک استفاده می شود. نیتروژن همچنین به عنوان پرکننده بی اثر، در مخزن های بزرگ برای نگهداری مایعات قابل انفجار، و در هنگام ساخت قطعات الکترونیک مانند ترانزیستور، دیود و مدار یکپارچه و همچنین برای ساخت فلزات ضدزنگ استفاده می شود. نیتروژن همچنین به صورت ماده خنک کننده، هم برای منجمد کردن غذا و هم ترابری آن، نگهداری اجساد و یاخته های تناسلی ( اسپرم و تخمک ) و غده های جنسی ( بیضه و تخمدان ) ، و در زیست شناسی برای نگهداری پایدار از نمونه های زیستی کاربرد دارد. نمک اسید نیتریک شامل ترکیبات مهمی مانند نیترات پتاسیوم و سدیم و نیترات آمونیوم است؛ که اولی برای تولید باروت و دومی برای تولید کود به کار می رود. ترکیبات نیترات شده مانند نیتروگلیسرین و تری نیترو تولوئن ( تی ان تی ) معمولاً منفجر شونده هستند.






wiki: نیتروژن
دانشنامه آزاد فارسی
نیتْروژِن (nitrogen)
(یا: ازت) برگرفته از کلمه ای یونانی به معنای سودای طبیعی (نیترات سدیم یا پتاسیم) عنصری غیرفلزی، گازی، بی مزه، بی بو، بی رنگ، با نماد N، عدد اتمی ۷، و جرم اتمی نسبی ۱۴.۰۰۶۷تقریباً ۸۰ درصد حجم اتمسفر زمین را تشکیل می دهد و از اجزای سازندۀ پروتئین ها و اسیدهای نوکلئیک در همۀ بافت های حیوانات و گیاهان است. در صنعت، نیتروژن را از طریق تقطیر جزءبه جزء و میعان هوا به دست می آورند. ترکیبات نیتروژن برای تولید مواد غذایی، دارو ها، کودهای شیمیایی، رنگینهها، و مواد منفجره به کار می روند. پیش از شناخت چرخۀ پیچیدۀ تثبیت نیتروژن، نیتروژن را مادۀ مغزی گیاهی ای می شناختند که در کودهای شیمیایی و مواد آلی دیگر یافت می شد. در ۱۷۷۲، شیمی دان انگلیسی، دانیل رادرفورد (۱۷۴۹ـ۱۸۱۹)، آن را جداسازی، و در ۱۷۹۰، شیمی دان فرانسوی، ژان شاپتال (۱۷۵۶ـ۱۸۳۲)، آن را نام گذاری کرد. از نیتروژن در فرآیند هابر برای تولید آمونیاک (NH۳) و همچنین برای ایجاد محیط خنثی در واکنش های شیمیایی خاص استفاده می کنند.
(یا: ازت) برگرفته از کلمه ای یونانی به معنای سودای طبیعی (نیترات سدیم یا پتاسیم) عنصری غیرفلزی، گازی، بی مزه، بی بو، بی رنگ، با نماد N، عدد اتمی ۷، و جرم اتمی نسبی ۱۴.۰۰۶۷تقریباً ۸۰ درصد حجم اتمسفر زمین را تشکیل می دهد و از اجزای سازندۀ پروتئین ها و اسیدهای نوکلئیک در همۀ بافت های حیوانات و گیاهان است. در صنعت، نیتروژن را از طریق تقطیر جزءبه جزء و میعان هوا به دست می آورند. ترکیبات نیتروژن برای تولید مواد غذایی، دارو ها، کودهای شیمیایی، رنگینهها، و مواد منفجره به کار می روند. پیش از شناخت چرخۀ پیچیدۀ تثبیت نیتروژن، نیتروژن را مادۀ مغزی گیاهی ای می شناختند که در کودهای شیمیایی و مواد آلی دیگر یافت می شد. در ۱۷۷۲، شیمی دان انگلیسی، دانیل رادرفورد (۱۷۴۹ـ۱۸۱۹)، آن را جداسازی، و در ۱۷۹۰، شیمی دان فرانسوی، ژان شاپتال (۱۷۵۶ـ۱۸۳۲)، آن را نام گذاری کرد. از نیتروژن در فرآیند هابر برای تولید آمونیاک (NH۳) و همچنین برای ایجاد محیط خنثی در واکنش های شیمیایی خاص استفاده می کنند.
wikijoo: نیتروژن
جدول کلمات
مترادف ها
نیتروژن، ازت
فارسی به عربی
پیشنهاد کاربران
عکس ریشه واژگان فارسی دکتر علی نورائی



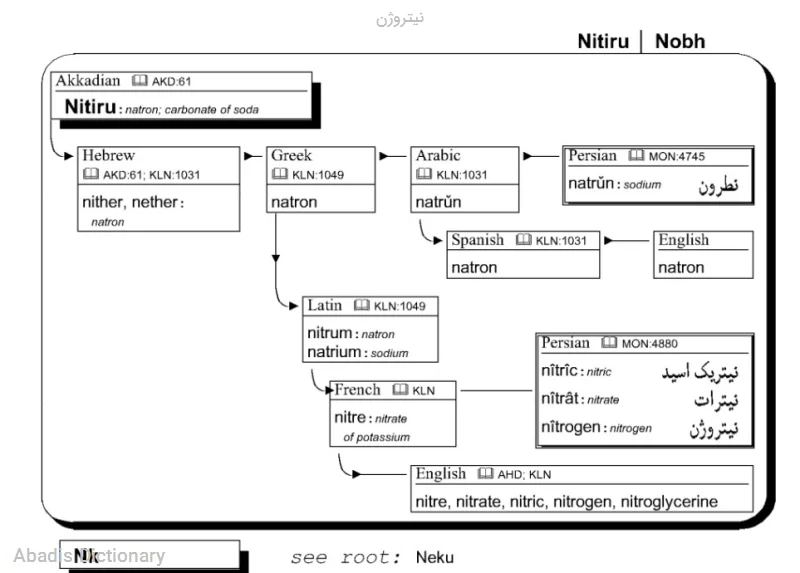




ازت
حمید رضا مشایخی - اصفهان
حمید رضا مشایخی - اصفهان
"پِیوا"
پِیوا نوواژه ای ست که به جای واژه ی نیتروژن پیشنهاد می شود.
پیوا: پِی=پایه - وا=وای=هوا
[وا، وای، وایو] نامواژه هایی ست که در اوستایی، سانسکریت و پهلوی به هوا گفته می شد و برای واژه سازی برای این خواسته می تواند کاربردی گردد.
... [مشاهده متن کامل]
پیوا= پایه ی هوا، دم یا گازی که چهارپنجم هوا را فراهم می سازد بدین روی این دم یا گاز را باید پایه ی هوا دانست.
پِیوا نوواژه ای ست که به جای واژه ی نیتروژن پیشنهاد می شود.
پیوا: پِی=پایه - وا=وای=هوا
[وا، وای، وایو] نامواژه هایی ست که در اوستایی، سانسکریت و پهلوی به هوا گفته می شد و برای واژه سازی برای این خواسته می تواند کاربردی گردد.
... [مشاهده متن کامل]
پیوا= پایه ی هوا، دم یا گازی که چهارپنجم هوا را فراهم می سازد بدین روی این دم یا گاز را باید پایه ی هوا دانست.
ازت
