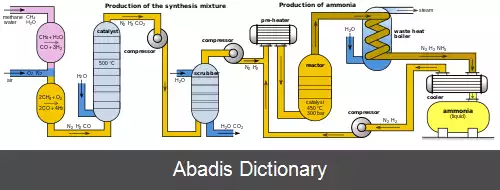
فرایند هابر ( به انگلیسی: Haber process ) یا فرایند هابر - بوش ( به انگلیسی: Haber–Bosch process ) روشی برای تولید صنعتی آمونیاک از طریق واکنش گاز نیتروژن و گاز هیدروژن و با استفاده از کاتالیزگرهای آهن و روتنیم ( در اغلب مواقع از ترکیبات ناخالص آن ها استفاده می شود ) است. در این فرایند به دمای ۴۵۰ سانتی گراد ( ۷۲۳درجه کلوین ) و فشار ۲۰۰ اتمسفر نیاز است. لابراتواری که این فرایند را کنترل می کند هابر لاب ( haber lab ) می نامند.
N 2 + 3 H 2 ⟶ 2 NH 3
این فرایند به طور مشترک توسط دو شیمیدان آلمانی به نام های فریتس هابر و کارل بوش که هر دو از برندگان جایزه نوبل شیمی بودند، ابداع شد. [ ۱] [ ۲] [ ۳] [ ۴]
پیش از ابداع این روش، تولید آمونیاک در مقیاس صنعتی بسیار دشوار بود[ ۵] [ ۲] [ ۶] و روش های قدیمی تولید آمونیاک نظیر فرایند بیرکلند - اید ( Birkeland Eyde process ) و فرایند فرانک کارو ( Frank Caro process ) به شدت ناکارامد بودند. روش فرانک - کارو نیاز به مقدار زیادی نیروی الکتریسیته دارد که فرایند هابر بی نیاز از آن است. [ ۲]
تولید سالانه کود نیتروژن به این روش بیش از ۱۰۰ میلیون تن است. خوراک بیش از نیمی از جمعیت کنونی جهان به تولید کود به این روش بستگی دارد. [ ۷] علاوه براین، این روش در جنگ جهانی اول به امپراتوری آلمان کمک کرد تا برای ساخت مواد منفجره، آمونیاک تولید کند در حالی که متفقین جنگ جهانی اول از نیتروناتریت استفاده می کردند در ادامه جنگ متفقین شیلی که محل تأمین نیتروناتریت آلمان بود را محاصره کردند. آلمان برای رفع نیاز خود از دانشمندان استفاده کرد و یکی از دانشمندان به نام هابر روشی برای ساخت آمونیاک ابداع کرد.
امونیاک+تولوئن =T. N. T[ ۸] [ ۲]
در قرن نوزدهم تقاضا برای نیترات و آمونیاک برای استفاده به عنوان کود و مواد اولیه صنعتی به طور پیوسته در حال افزایش بود. اگرچه نیتروژن اتمسفر ( N2 ) فراوان است و ۷۸ درصد حجمی هوا را تشکیل می دهد، اما به طور خاصی پایدار است و به آسانی با سایر مواد شیمیایی واکنش نشان نمی دهد. تبدیل N2 به آمونیاک چالشی را برای شیمیدانان در سطح جهان ایجاد کرد.
هابر، به همراه دستیارش رابرت لو روسیگنول ( Robert Le Rossignol ) ، دستگاه های قوی و کاتالیزگرهای مورد نیاز برای نشان دادن فرایند هابر در مقیاس آزمایشگاهی را توسعه دادند. آنها فرایند خود را در تابستان ۱۹۰۹ با گرفتن آمونیاک از هوا، قطره قطره، با سرعت حدود ۱۲۵ میلی لیتر در ساعت نشان دادند. امتیاز این فرایند توسط شرکت آلمانی بی اِی اِس اِف خریداری شد، و وظیفه بزرگ کردن ماشین رومیزی هابر را برای تولید در سطح صنعتی به کارل بوش واگذار شد. در سال ۱۹۱۰ او موفق شد. هابر و بوش بعداً به ترتیب در سال های ۱۹۱۸ و ۱۹۳۱ به دلیل تلاش در غلبه بر مواد شیمیایی و مشکلات مهندسی در مقیاس وسیع، جریان پیوسته و تکنولوژی فشار بالا، جوایز نوبل دریافت کردند. [ ۹]
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفN 2 + 3 H 2 ⟶ 2 NH 3
این فرایند به طور مشترک توسط دو شیمیدان آلمانی به نام های فریتس هابر و کارل بوش که هر دو از برندگان جایزه نوبل شیمی بودند، ابداع شد. [ ۱] [ ۲] [ ۳] [ ۴]
پیش از ابداع این روش، تولید آمونیاک در مقیاس صنعتی بسیار دشوار بود[ ۵] [ ۲] [ ۶] و روش های قدیمی تولید آمونیاک نظیر فرایند بیرکلند - اید ( Birkeland Eyde process ) و فرایند فرانک کارو ( Frank Caro process ) به شدت ناکارامد بودند. روش فرانک - کارو نیاز به مقدار زیادی نیروی الکتریسیته دارد که فرایند هابر بی نیاز از آن است. [ ۲]
تولید سالانه کود نیتروژن به این روش بیش از ۱۰۰ میلیون تن است. خوراک بیش از نیمی از جمعیت کنونی جهان به تولید کود به این روش بستگی دارد. [ ۷] علاوه براین، این روش در جنگ جهانی اول به امپراتوری آلمان کمک کرد تا برای ساخت مواد منفجره، آمونیاک تولید کند در حالی که متفقین جنگ جهانی اول از نیتروناتریت استفاده می کردند در ادامه جنگ متفقین شیلی که محل تأمین نیتروناتریت آلمان بود را محاصره کردند. آلمان برای رفع نیاز خود از دانشمندان استفاده کرد و یکی از دانشمندان به نام هابر روشی برای ساخت آمونیاک ابداع کرد.
امونیاک+تولوئن =T. N. T[ ۸] [ ۲]
در قرن نوزدهم تقاضا برای نیترات و آمونیاک برای استفاده به عنوان کود و مواد اولیه صنعتی به طور پیوسته در حال افزایش بود. اگرچه نیتروژن اتمسفر ( N2 ) فراوان است و ۷۸ درصد حجمی هوا را تشکیل می دهد، اما به طور خاصی پایدار است و به آسانی با سایر مواد شیمیایی واکنش نشان نمی دهد. تبدیل N2 به آمونیاک چالشی را برای شیمیدانان در سطح جهان ایجاد کرد.
هابر، به همراه دستیارش رابرت لو روسیگنول ( Robert Le Rossignol ) ، دستگاه های قوی و کاتالیزگرهای مورد نیاز برای نشان دادن فرایند هابر در مقیاس آزمایشگاهی را توسعه دادند. آنها فرایند خود را در تابستان ۱۹۰۹ با گرفتن آمونیاک از هوا، قطره قطره، با سرعت حدود ۱۲۵ میلی لیتر در ساعت نشان دادند. امتیاز این فرایند توسط شرکت آلمانی بی اِی اِس اِف خریداری شد، و وظیفه بزرگ کردن ماشین رومیزی هابر را برای تولید در سطح صنعتی به کارل بوش واگذار شد. در سال ۱۹۱۰ او موفق شد. هابر و بوش بعداً به ترتیب در سال های ۱۹۱۸ و ۱۹۳۱ به دلیل تلاش در غلبه بر مواد شیمیایی و مشکلات مهندسی در مقیاس وسیع، جریان پیوسته و تکنولوژی فشار بالا، جوایز نوبل دریافت کردند. [ ۹]


wiki: فرایند هابر
