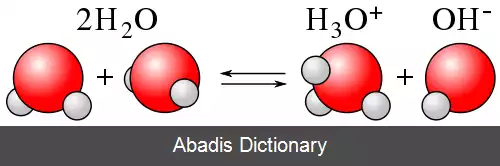
نظریهٔ اسید - باز برونستد–لوری ( به انگلیسی: Brønsted–Lowry ) یک نظریه پیرامون واکنش اسید و باز است که در سال ۱۹۲۳ به طور مستقل توسط یوهانس نیکولاوس برونستد و توماس مارتین لوری پیشنهاد شد. مفهوم اساسی این نظریه این است که وقتی یک اسید و یک باز با یکدیگر واکنش نشان می دهند، اسید، باز مزدوج خود را و باز هم اسید مزدوج خود را تشکیل می دهد. این فرایند با تبادل یک پروتون ( کاتیون هیدروژن یا +H ) صورت می پذیرد. تا پیش از مطرح شدن این نظریه، نظریهٔ قالب در مجامع علمی توسط سوانت آرنیوس مطرح شده بود که از جامعیت کافی برخوردار نبود و در توضیح بسیاری از واکنش ها ناتوان بود. آرنیوس معتقد بود که اسید ماده ای است که در محلول آبی تفکیک شده و یون هیدروژن ( +H ) تولید می کند و باز ماده ای است که در محلول آبی تفکیکی شده و یون هیدروکسید ( −OH ) تولید می کند. نظریهٔ برونستد–لوری شکل تعمیم یافته ای از نظریه آرنیوس پیرامون اسیدها و بازها است، اما این نظریه نیز با تمام قوت های خود، کاستی هایی دارد از جمله این که برای واکنش هایی که در آن هیدروژن مبادله نمی شود یا در واکنش های مواد جامد، چندان کارایی ندارد.
پس از برونستد و لوری، گیلبرت لوئیس با مطرح کردن مفهوم اشتراک جفت الکترون ناپیوندی در واکنش ها، مشکل برونستد و لوری در واکنش های بدون تبادل پروتون را حل کرد. لوئیس معتقد بود باز ماده ای است که جفت الکترون ناپیوندی از دست می دهد و اسید ماده ای است که جفت الکترون ناپیوندی را می پذیرد. در طی این تبادل الکترون یک پیوند کووالانسی از نوع داتیو تشکیل می شود.
همچنین با مطرح شدن نظریه لوکس−فلود، مشکل واکنش های در حالت جامد نیز برطرف شد. طبق این نظریه جابجایی یون اکسید ( O2− ) عامل تشخیص اسید و باز است به این صورت که اسید به عنوان ماده ای تعریف می شود که O2− می گیرد و باز ماده ای است که O2− از دست می دهد.
در نظریه آرنیوس، اسیدها به عنوان موادی تعریف می شوند که در محلول آبی تفکیک شده و +H ( یون های هیدروژن یا همون پروتون ) آزاد می کنند، در حالی که بازها موادی تعریف می شوند که در محلول آبی تفکیک شده و −OH ( یون های هیدروکسید ) را به وجود می آورند. [ ۱]
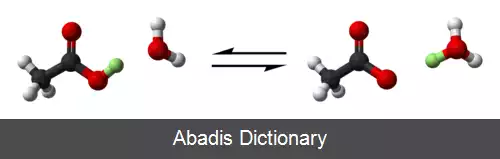
در سال ۱۹۲۳ دو شیمی فیزیک دان به نام های یوهانس نیکولاس برونستد در دانمارک و توماس مارتین لوری در انگلستان به طور مستقل از یکدیگر نظریه ای را ارائه دادند که نام آن ها بر آن نهاده شد. [ ۲] [ ۳] [ ۴] [ ۵] [ ۶] در نظریه برونستد–لوری، اسیدها و بازها بر اساس روشی که با یکدیگر واکنش نشان می دهند، تعریف می شوند؛ این امر موجب می شود که بتوان این نظریه را به انواع مختلفی از اسیدها و بازها تعمیم داد. این نظریه در معادلهٔ تعادلی زیر بیان شده است: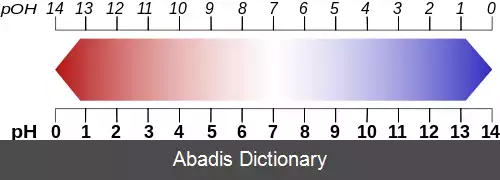


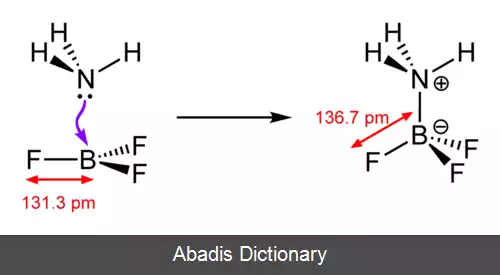
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفپس از برونستد و لوری، گیلبرت لوئیس با مطرح کردن مفهوم اشتراک جفت الکترون ناپیوندی در واکنش ها، مشکل برونستد و لوری در واکنش های بدون تبادل پروتون را حل کرد. لوئیس معتقد بود باز ماده ای است که جفت الکترون ناپیوندی از دست می دهد و اسید ماده ای است که جفت الکترون ناپیوندی را می پذیرد. در طی این تبادل الکترون یک پیوند کووالانسی از نوع داتیو تشکیل می شود.
همچنین با مطرح شدن نظریه لوکس−فلود، مشکل واکنش های در حالت جامد نیز برطرف شد. طبق این نظریه جابجایی یون اکسید ( O2− ) عامل تشخیص اسید و باز است به این صورت که اسید به عنوان ماده ای تعریف می شود که O2− می گیرد و باز ماده ای است که O2− از دست می دهد.
در نظریه آرنیوس، اسیدها به عنوان موادی تعریف می شوند که در محلول آبی تفکیک شده و +H ( یون های هیدروژن یا همون پروتون ) آزاد می کنند، در حالی که بازها موادی تعریف می شوند که در محلول آبی تفکیک شده و −OH ( یون های هیدروکسید ) را به وجود می آورند. [ ۱]
در سال ۱۹۲۳ دو شیمی فیزیک دان به نام های یوهانس نیکولاس برونستد در دانمارک و توماس مارتین لوری در انگلستان به طور مستقل از یکدیگر نظریه ای را ارائه دادند که نام آن ها بر آن نهاده شد. [ ۲] [ ۳] [ ۴] [ ۵] [ ۶] در نظریه برونستد–لوری، اسیدها و بازها بر اساس روشی که با یکدیگر واکنش نشان می دهند، تعریف می شوند؛ این امر موجب می شود که بتوان این نظریه را به انواع مختلفی از اسیدها و بازها تعمیم داد. این نظریه در معادلهٔ تعادلی زیر بیان شده است:






