مرکز F. مرکز F یا مرکز Farbe ( از لغت آلمانی Farbzentrum که Farbe به معنی رنگ و zentrum به معنای مرکز است ) نوعی نقص کریستالوگرافی است که در آن یک جای خالی آنیونی در شبکه بلوری توسط یک یا چند الکترون جفت نشده اشغال می شود. الکترون ها در چنین فضای خالی در شبکه کریستالی تمایل دارند نور را در طیف مرئی جذب کنند به طوری که ماده ای که معمولاً شفاف است رنگی می شود. هر چه تعداد مراکز F بیشتر باشد، رنگ ترکیب شدیدتر است. مراکز F نوعی مرکز رنگ هستند.
این برای شناسایی بسیاری از ترکیبات، به ویژه اکسید روی ( زرد ) استفاده می شود.
قبل از کشف عیوب نقطه ای، قبلاً شناخته شده بود که برخی از کریستال ها را می توان با استفاده از روش های مختلف تغییر رنگ داد. در سال 1830 تی جی پیرسال ( T. J. Pearsall ) کشف کرد که فلورسپار را می توان با استفاده از نور بنفش تغییر رنگ داد. [ ۱] سی سال بعد نتایج مشابهی با ذوب کریستال ها با یک فلز خاص به دست آمد. در سال 1921W. Röntgen به طور گسترده سنگ نمک را اندازه گیری کرد. یکی از این آزمایش ها پس از تابش نمک با اشعه ایکس، رسانایی فوتوالکتریک را 40000 برابر بزرگ تر، اندازه گیری کرد. نتیجه مشابه با اشعه ایکس با رنگ آمیزی کریستال ها با بخارات فلزی به دست آمد. اثر فوتوالکتریک عمدتاً در اطراف طول موج های خاص اتفاق می افتد که بعداً مشخص شد که ماهیت آن غیرکلوئیدی است.
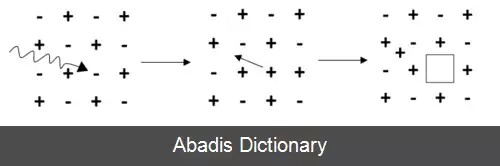
تغییر رنگ ها بعداً به نام مراکز F نامیده شدند، برگرفته از لغت Farbe، کلمه آلمانی به معنای رنگ. در سال 1933 مولوو ( Mollwo ) به این نتیجه رسید که این مراکز F دارای نقص کریستالی اتمی هستند. در این زمان مردم شروع به ادعا کردند که این نقص ها الکترون های جفت نشده هستند. مدل جای خالی برای اولین بار در سال 1937 توصیف شد اما هنوز آزمایشی در نظر گرفته می شد. در سال 1957 اثبات شد که این موضوع با استفاده از رزونانس اسپین الکترون درست است.
مراکز F می توانند به طور طبیعی در ترکیبات ( به ویژه اکسیدهای فلزی ) وجود داشته باشند، زیرا وقتی تا دمای بالا گرم می شوند، یون ها برانگیخته می شوند و از موقعیت های کریستالوگرافی معمولی خود جابه جا شده و تعدادی الکترون در فضاهای خالی باقی می مانند. این اثر همچنین توسط ترکیبات یونی حاوی نقص های اضافی فلزی نشان داده می شود.
اغلب مراکز F پارامغناطیس هستند و می توان آنها را با تکنیک های تشدید پارامغناطیس الکترونی مطالعه کرد. [ ۲] مراکز F که بیشتر مورد مطالعه قرار می گیرند مراکزی هستند که در هالیدهای فلزات قلیایی وجود دارند. هالیدهای فلز قلیایی شفاف هستند و از اشعه ماوراء بنفش دور {{به انگلیسی|far ultraviolet}} به مادون قرمز دور {{به انگلیسی|far infrared}} جذب نمی شوند. بنابراین هرگونه تغییر در جذب نوری به راحتی قابل شناسایی و مطالعه است. : 5 نوار جذب مراکز F در کلرید سدیم در اطراف نور آبی قرار دارد و به کریستال کلرید سدیم با نقص مرکز F کافی رنگ زرد می دهد. در سایر کلریدهای قلیایی، محل نوار جذب مرکز F از نور بنفش تا نور زرد متغیر است. [ ۳] تشکیل مراکز F به دلیل این است که برخی از کریستال ها مانند کلرید لیتیوم ، کلرید پتاسیم و اکسید روی با حرارت دادن به ترتیب صورتی، یاسی و زرد می شوند.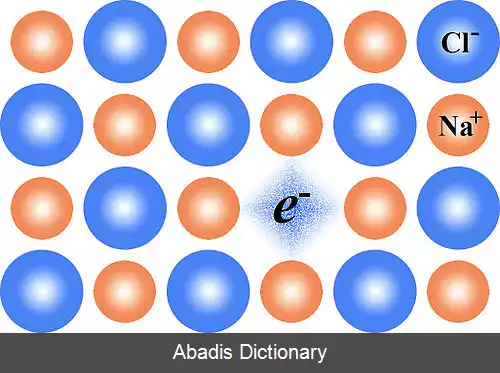



این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاین برای شناسایی بسیاری از ترکیبات، به ویژه اکسید روی ( زرد ) استفاده می شود.
قبل از کشف عیوب نقطه ای، قبلاً شناخته شده بود که برخی از کریستال ها را می توان با استفاده از روش های مختلف تغییر رنگ داد. در سال 1830 تی جی پیرسال ( T. J. Pearsall ) کشف کرد که فلورسپار را می توان با استفاده از نور بنفش تغییر رنگ داد. [ ۱] سی سال بعد نتایج مشابهی با ذوب کریستال ها با یک فلز خاص به دست آمد. در سال 1921W. Röntgen به طور گسترده سنگ نمک را اندازه گیری کرد. یکی از این آزمایش ها پس از تابش نمک با اشعه ایکس، رسانایی فوتوالکتریک را 40000 برابر بزرگ تر، اندازه گیری کرد. نتیجه مشابه با اشعه ایکس با رنگ آمیزی کریستال ها با بخارات فلزی به دست آمد. اثر فوتوالکتریک عمدتاً در اطراف طول موج های خاص اتفاق می افتد که بعداً مشخص شد که ماهیت آن غیرکلوئیدی است.
تغییر رنگ ها بعداً به نام مراکز F نامیده شدند، برگرفته از لغت Farbe، کلمه آلمانی به معنای رنگ. در سال 1933 مولوو ( Mollwo ) به این نتیجه رسید که این مراکز F دارای نقص کریستالی اتمی هستند. در این زمان مردم شروع به ادعا کردند که این نقص ها الکترون های جفت نشده هستند. مدل جای خالی برای اولین بار در سال 1937 توصیف شد اما هنوز آزمایشی در نظر گرفته می شد. در سال 1957 اثبات شد که این موضوع با استفاده از رزونانس اسپین الکترون درست است.
مراکز F می توانند به طور طبیعی در ترکیبات ( به ویژه اکسیدهای فلزی ) وجود داشته باشند، زیرا وقتی تا دمای بالا گرم می شوند، یون ها برانگیخته می شوند و از موقعیت های کریستالوگرافی معمولی خود جابه جا شده و تعدادی الکترون در فضاهای خالی باقی می مانند. این اثر همچنین توسط ترکیبات یونی حاوی نقص های اضافی فلزی نشان داده می شود.
اغلب مراکز F پارامغناطیس هستند و می توان آنها را با تکنیک های تشدید پارامغناطیس الکترونی مطالعه کرد. [ ۲] مراکز F که بیشتر مورد مطالعه قرار می گیرند مراکزی هستند که در هالیدهای فلزات قلیایی وجود دارند. هالیدهای فلز قلیایی شفاف هستند و از اشعه ماوراء بنفش دور {{به انگلیسی|far ultraviolet}} به مادون قرمز دور {{به انگلیسی|far infrared}} جذب نمی شوند. بنابراین هرگونه تغییر در جذب نوری به راحتی قابل شناسایی و مطالعه است. : 5 نوار جذب مراکز F در کلرید سدیم در اطراف نور آبی قرار دارد و به کریستال کلرید سدیم با نقص مرکز F کافی رنگ زرد می دهد. در سایر کلریدهای قلیایی، محل نوار جذب مرکز F از نور بنفش تا نور زرد متغیر است. [ ۳] تشکیل مراکز F به دلیل این است که برخی از کریستال ها مانند کلرید لیتیوم ، کلرید پتاسیم و اکسید روی با حرارت دادن به ترتیب صورتی، یاسی و زرد می شوند.





wiki: مرکز F
