فشار بخار ( بخار اشباع ) یا فشار بخار تعادل به عنوان فشار اعمال شده توسط بخار در تعادل ترمودینامیکی با فازهای تراکم آن ( جامد یا مایع ) در یک سیستم بسته تعریف می شود. فشار بخار تعادل نشانه ای از میزان تبخیر مایع است. این مربوط به گرایش ذرات برای فرار از مایع ( یا جامد ) است. ماده ای با فشار بخار بالا در دمای طبیعی اغلب به عنوان فرار شناخته می شود. فشار ناشی از بخار موجود در بالای سطح مایع به عنوان فشار بخار شناخته می شود. با افزایش دمای مایع، انرژی جنبشی مولکول های آن نیز افزایش می یابد و انتقال مولکول ها به بخار نیز افزایش می یابد، در نتیجه فشار بخار افزایش می یابد.
اگر فشار بخار بیش از مقدار تعادل ترمودینامیکی باشد، تراکم در حضور سایت های هسته ای رخ می دهد. این اصل بومی در اتاق های ابر است، جایی که ذرات یونیزه هنگام عبور از آنها، آهنگ های تراکم را تشکیل می دهند.
فشار بخار هر ماده با توجه به رابطه Clapeyron - Clausius به طور غیر خطی با درجه حرارت افزایش می یابد. نقطه جوش فشار اتمسفر مایع ( نقطه جوش طبیعی ) درجه حرارتی است که در آن فشار بخار برابر فشار اتمسفر محیط است. با افزایش در این درجه حرارت، فشار بخار برای غلبه بر فشار اتمسفر کافی است و مایع را به شکل حباب های بخار داخل بخش عمده ماده درمی آورد. تشکیل حباب در اعماق مایع به دلیل افزایش فشار نیاز به دمای بالاتری دارد. کشش سطحی ناشی از دیواره حباب منجر به فشار بیش از حد در حباب های بسیار کوچک و اولیه می شود. فشار بخاری که یک جزء در یک مخلوط به فشار کلی سیستم اضافه می کند، فشار جزئی نامیده می شود. به عنوان مثال، هوا در سطح دریا، و اشباع با بخار آب در دمای ۲۰ درجه سانتیگراد، فشار جزئی حدود ۳٫۲ کیلوپاسکال از آب، ۷۸ کیلوپاسکال از نیتروژن، ۲۱ کیلوپاسکال از اکسیژن و ۹٫۰ کیلوپاسکال از آرگون را دارد، که درکل 2. 102 KPa بر پایه فشار استاندارد اتمسفر می باشد.
فشار بخار در واحدهای استاندارد فشار اندازه گیری می شود. سیستم بین المللی واحدهای ( SI ) فشار را به عنوان یک واحد مشتق شده با واحد نیرو بر سطح تشخیص می دهد و پاسکال ( PA ) را به عنوان واحد استاندارد آن تعیین می کند. یک پاسکال یک نیوتن در هر متر مربع ( N·m−۲ یا kg·m−۱·s−۲ ) است. اندازه گیری تجربی فشار بخار یک روش ساده برای فشار رایج بین ۱ تا ۲۰۰ کیلوپاسکال می باشد. دقیق ترین نتایج، در نزدیکی نقطه جوش مواد و پرخطاترین نتایج به دست آمده برای اندازه گیری های کوچکتر از 1 KPa است. مراحل اغلب شامل تمیز کردن مواد آزمایشی، ایزوله کردن در یک ظرف، تخلیه هر گاز خارجی، سپس اندازه گیری فشار تعادل فاز گاز از ماده در ظرف در دمای مختلف می باشد. زمانی نتیجه دقیق تر به دست می آید که تمام نکات رعایت شده و اطمینان حاصل شود که کل ماده و بخار آن در دمای تجویز شده قرار دارد. این کار مثلاً با استفاده از یک ایزوتنسیکوپ، با غوطه ور شدن محل نگهداری در یک حمام مایع انجام می شود. فشار بخارهای کم در جامدات را می توان با استفاده از روش Knudsen effusion cell اندازه گیری کرد. در یک زمینه پزشکی، فشار بخار گاهی اوقات در واحدهای دیگر بیان می شود، به طور خاص میلی متر جیوه ( MMHG ) برای داروهای بی هوشی فرار بسیار مهم است که اکثر آنها مایعات با دمای بدن هستند، اما با فشار بخار نسبتاً بالا.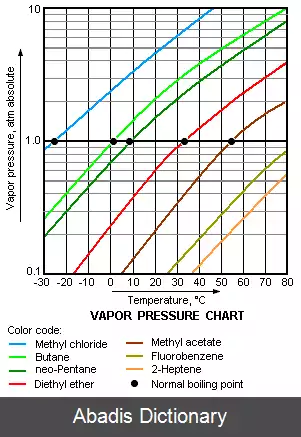
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاگر فشار بخار بیش از مقدار تعادل ترمودینامیکی باشد، تراکم در حضور سایت های هسته ای رخ می دهد. این اصل بومی در اتاق های ابر است، جایی که ذرات یونیزه هنگام عبور از آنها، آهنگ های تراکم را تشکیل می دهند.
فشار بخار هر ماده با توجه به رابطه Clapeyron - Clausius به طور غیر خطی با درجه حرارت افزایش می یابد. نقطه جوش فشار اتمسفر مایع ( نقطه جوش طبیعی ) درجه حرارتی است که در آن فشار بخار برابر فشار اتمسفر محیط است. با افزایش در این درجه حرارت، فشار بخار برای غلبه بر فشار اتمسفر کافی است و مایع را به شکل حباب های بخار داخل بخش عمده ماده درمی آورد. تشکیل حباب در اعماق مایع به دلیل افزایش فشار نیاز به دمای بالاتری دارد. کشش سطحی ناشی از دیواره حباب منجر به فشار بیش از حد در حباب های بسیار کوچک و اولیه می شود. فشار بخاری که یک جزء در یک مخلوط به فشار کلی سیستم اضافه می کند، فشار جزئی نامیده می شود. به عنوان مثال، هوا در سطح دریا، و اشباع با بخار آب در دمای ۲۰ درجه سانتیگراد، فشار جزئی حدود ۳٫۲ کیلوپاسکال از آب، ۷۸ کیلوپاسکال از نیتروژن، ۲۱ کیلوپاسکال از اکسیژن و ۹٫۰ کیلوپاسکال از آرگون را دارد، که درکل 2. 102 KPa بر پایه فشار استاندارد اتمسفر می باشد.
فشار بخار در واحدهای استاندارد فشار اندازه گیری می شود. سیستم بین المللی واحدهای ( SI ) فشار را به عنوان یک واحد مشتق شده با واحد نیرو بر سطح تشخیص می دهد و پاسکال ( PA ) را به عنوان واحد استاندارد آن تعیین می کند. یک پاسکال یک نیوتن در هر متر مربع ( N·m−۲ یا kg·m−۱·s−۲ ) است. اندازه گیری تجربی فشار بخار یک روش ساده برای فشار رایج بین ۱ تا ۲۰۰ کیلوپاسکال می باشد. دقیق ترین نتایج، در نزدیکی نقطه جوش مواد و پرخطاترین نتایج به دست آمده برای اندازه گیری های کوچکتر از 1 KPa است. مراحل اغلب شامل تمیز کردن مواد آزمایشی، ایزوله کردن در یک ظرف، تخلیه هر گاز خارجی، سپس اندازه گیری فشار تعادل فاز گاز از ماده در ظرف در دمای مختلف می باشد. زمانی نتیجه دقیق تر به دست می آید که تمام نکات رعایت شده و اطمینان حاصل شود که کل ماده و بخار آن در دمای تجویز شده قرار دارد. این کار مثلاً با استفاده از یک ایزوتنسیکوپ، با غوطه ور شدن محل نگهداری در یک حمام مایع انجام می شود. فشار بخارهای کم در جامدات را می توان با استفاده از روش Knudsen effusion cell اندازه گیری کرد. در یک زمینه پزشکی، فشار بخار گاهی اوقات در واحدهای دیگر بیان می شود، به طور خاص میلی متر جیوه ( MMHG ) برای داروهای بی هوشی فرار بسیار مهم است که اکثر آنها مایعات با دمای بدن هستند، اما با فشار بخار نسبتاً بالا.

wiki: فشار بخار
