سلول تی کایمریک گیرنده آنتی ژن. سلول تی کایمریک گیرنده آنتی ژن ( به انگلیسی: Chimeric antigen receptor T cell ) نوعی روش درمان سرطان است که از روش های سلول درمانی با پایه ایمونوتراپی و مهندسی ژنتیک جهت بهبود بیماران مبتلا به انواع سرطان های خونی، با استفاده از سلول های خونی خود فرد بیمار ( اتولوگ ) استفاده می کند. این رویکرد در درمان برخی از بدخیمی های خونی موفقیت آمیز بوده است و برای سایر تومورها نیز در حال کارآزمایی است. CARها گیرنده های مهندسی ژنتیک شده حاوی محل های اتصال اختصاصی آنتی ژن توموری می باشند که توسط ژنهای نوترکیب ناحیه متغیر ایمنوگلوبولین ( آنتی بادی، پادتن ) کد می شوند و دم سیتوپلاسمی آنها حاوی دومین های سیگنال رسانی هر دو گیرنده سلول T ( لنفوسیت تی از انواع سلول های سیستم ایمنی بدن است ) و پذیرنده های کمک تحریکی است.
دلیل استفاده از ایمنوگلوبولین ها با یک جایگاه اتصال اختصاصی برای آنتی ژن توموری بعنوان پذیرندهٔ شناسایی کننده، با اینکه در سلول های T باید عمل کند، این است که مشکل محدودیت به MHC ( مجموعه سازگاری بافتی اصلی ) گیرنده سلول های T را ندارد، بنابراین یک ساختار CAR یکسان در هر بیماری می تواند استفاده شود. جایگاه اتصال ایمونوگلوبولین به یک دم سیتوپلاسمی مهندسی شده متصل شده است که حاوی دومین های سیگنال رسانی است که به طور طبیعی نقش های ضروری در فعال سازی سلول T دارند. تا کنون چندین نوع متفاوت از ساختارهای انتقال سیگنال در CARهای تولیدشده در مراکز مختلف استفاده شده است، اما همگی موتیف های ITAM زنجیرهٔ زتای TCR ( گیرنده لنفوسیت تی ) و موتیف های انتقال سیگنال سیتوپلاسمی از پذیرنده های کمک تحریکی نظیر CD28 یا 4 - 1BB ( یک عضو خانواده پذیرنده یTNF ) را دارند. بیان این دومین های انتقال سیگنال توانایی فعال سازی سلول T را به گیرنده های ایمنوگلوبولینی اختصاصی تومور اعطا می کند.
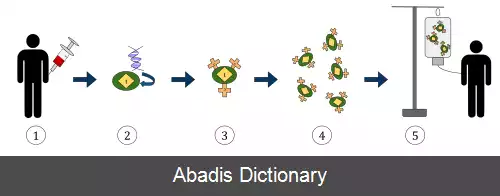
در پروتکل رایج، سلول های T خون محیطی بیماران جدا شده و با آنتی بادی های anti - CD33 یا anti - CD28 به منظور تکثیر همه سلول های T، تحریک می شوند و با پلاسمیدهای لنتی ویروس یا رتروویروس کُدکننده CAR ترنسفکت ( دستکاری ژنتیکی ) می شوند. سپس سلول های T بیان کنندهٔ CAR تکثیر یافته مجدداً به بیمار تزریق می شوند. سلول های T منتقل شده به بیماران، در پاسخ به شناسایی آنتی ژن توموری توسط CAR، تکثیر شدیدتری پیدا می کند. اختصاصیت گیرنده سلول Tهای سطح این سلولهای T ( که همچنان حضور دارند ) با هدف کشتن سلولهای توموری ارتباطی ندارد، زیرا همهٔ سلول های ترنسفکت شده می توانند با اتصال آنتی ژن توموری به جایگاه اتصال آنتی ژن کد شده توسط ژن CAR فعال شوند. از بین رفتن تومور هم با مکانیسم های مستقیم سیتوتوکسیک ( انگلیسی: cytotoxic T - lymphocyte - associated protein 4 ) و هم با مکانیسمهای وابسته به سیتوکاین ( سیتوکین ها دسته ای از مولکول های پروتئینی محلول در آب هستند که از یاخته های گوناگون و بیشتر در پاسخ به یک تحریک، ترشح می شوند و وظیفهٔ انتقال پیام بین یاخته ها را برعهده دارند ) انجام می گیرد. بیماران مبتلا به بدخیمی های سلول های B، از قبیل لوسمی لنفوسیتی مزمن و لوسمی لنفوبلاستی حاد، به طور مؤثر توسط سلولهای T بارز کننده CAR اختصاصی برای CD19، یک مارکر عمومی سلول B ( pan - B cell marker ) که روی سلول های توموری هم بیان می شود، درمان شده اند. سلول های B طبیعی نیز همانند سلول های B توموری از بین می روند، اما بیماران با مخلوط ایمونوگلوبولین به منظور جبران فقدان سلول های B حمایت می شوند. پلاسماسل های تولیدکننده آنتی بادی با طول عمر طولانی، که در مغز استخوان بالغین و بافت های مخاطی یافت می شوند، CD19 را بارز نمی کنند و کشته نمی شوند، در نتیجه آنها به ایجاد ایمنی وابسته به آنتی بادی در بیماران بالغ درمان شده با سلول های CAR - T اختصاصی CD19 ادامه می دهند. سلول های خاطرهٔ CAR - T ممکن است برای حداقل چند ماه در بیماران درمان شده باقی بمانند، به طوری که مراقبت علیه عود تومور حفظ می شود. درمان با CAR برای درمان بدخیمی های سول B مقاوم به سایر درمانها در چندین مرکز پزشکی در دنیا انجام می شود، و امکانات زیادی ایجاد شده است که می توانند تعداد زیادی از سلول های CAR - T را در یک زمان کوتاه برای هر بیمار تولید کنند. [ ۱]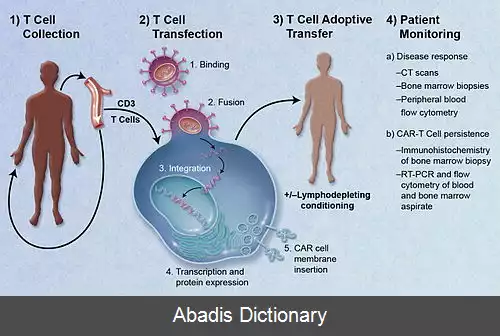
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدلیل استفاده از ایمنوگلوبولین ها با یک جایگاه اتصال اختصاصی برای آنتی ژن توموری بعنوان پذیرندهٔ شناسایی کننده، با اینکه در سلول های T باید عمل کند، این است که مشکل محدودیت به MHC ( مجموعه سازگاری بافتی اصلی ) گیرنده سلول های T را ندارد، بنابراین یک ساختار CAR یکسان در هر بیماری می تواند استفاده شود. جایگاه اتصال ایمونوگلوبولین به یک دم سیتوپلاسمی مهندسی شده متصل شده است که حاوی دومین های سیگنال رسانی است که به طور طبیعی نقش های ضروری در فعال سازی سلول T دارند. تا کنون چندین نوع متفاوت از ساختارهای انتقال سیگنال در CARهای تولیدشده در مراکز مختلف استفاده شده است، اما همگی موتیف های ITAM زنجیرهٔ زتای TCR ( گیرنده لنفوسیت تی ) و موتیف های انتقال سیگنال سیتوپلاسمی از پذیرنده های کمک تحریکی نظیر CD28 یا 4 - 1BB ( یک عضو خانواده پذیرنده یTNF ) را دارند. بیان این دومین های انتقال سیگنال توانایی فعال سازی سلول T را به گیرنده های ایمنوگلوبولینی اختصاصی تومور اعطا می کند.
در پروتکل رایج، سلول های T خون محیطی بیماران جدا شده و با آنتی بادی های anti - CD33 یا anti - CD28 به منظور تکثیر همه سلول های T، تحریک می شوند و با پلاسمیدهای لنتی ویروس یا رتروویروس کُدکننده CAR ترنسفکت ( دستکاری ژنتیکی ) می شوند. سپس سلول های T بیان کنندهٔ CAR تکثیر یافته مجدداً به بیمار تزریق می شوند. سلول های T منتقل شده به بیماران، در پاسخ به شناسایی آنتی ژن توموری توسط CAR، تکثیر شدیدتری پیدا می کند. اختصاصیت گیرنده سلول Tهای سطح این سلولهای T ( که همچنان حضور دارند ) با هدف کشتن سلولهای توموری ارتباطی ندارد، زیرا همهٔ سلول های ترنسفکت شده می توانند با اتصال آنتی ژن توموری به جایگاه اتصال آنتی ژن کد شده توسط ژن CAR فعال شوند. از بین رفتن تومور هم با مکانیسم های مستقیم سیتوتوکسیک ( انگلیسی: cytotoxic T - lymphocyte - associated protein 4 ) و هم با مکانیسمهای وابسته به سیتوکاین ( سیتوکین ها دسته ای از مولکول های پروتئینی محلول در آب هستند که از یاخته های گوناگون و بیشتر در پاسخ به یک تحریک، ترشح می شوند و وظیفهٔ انتقال پیام بین یاخته ها را برعهده دارند ) انجام می گیرد. بیماران مبتلا به بدخیمی های سلول های B، از قبیل لوسمی لنفوسیتی مزمن و لوسمی لنفوبلاستی حاد، به طور مؤثر توسط سلولهای T بارز کننده CAR اختصاصی برای CD19، یک مارکر عمومی سلول B ( pan - B cell marker ) که روی سلول های توموری هم بیان می شود، درمان شده اند. سلول های B طبیعی نیز همانند سلول های B توموری از بین می روند، اما بیماران با مخلوط ایمونوگلوبولین به منظور جبران فقدان سلول های B حمایت می شوند. پلاسماسل های تولیدکننده آنتی بادی با طول عمر طولانی، که در مغز استخوان بالغین و بافت های مخاطی یافت می شوند، CD19 را بارز نمی کنند و کشته نمی شوند، در نتیجه آنها به ایجاد ایمنی وابسته به آنتی بادی در بیماران بالغ درمان شده با سلول های CAR - T اختصاصی CD19 ادامه می دهند. سلول های خاطرهٔ CAR - T ممکن است برای حداقل چند ماه در بیماران درمان شده باقی بمانند، به طوری که مراقبت علیه عود تومور حفظ می شود. درمان با CAR برای درمان بدخیمی های سول B مقاوم به سایر درمانها در چندین مرکز پزشکی در دنیا انجام می شود، و امکانات زیادی ایجاد شده است که می توانند تعداد زیادی از سلول های CAR - T را در یک زمان کوتاه برای هر بیمار تولید کنند. [ ۱]


