ساختار لوویس ( به انگلیسی: Lewis structure ) یا ساختار الکترون نقطه[ ۱] ( به انگلیسی: electron dot structure ) یا ساختار پیوند ظرفیتی[ ۲] ( به انگلیسی: Valence - bond structure ) ساختاری برای نمایش مولکول یا یون در شیمی است که در آن عناصر را با نماد شیمیایی، الکترون های ظرفیتی ناپیوندی را با نقطه و پیوندها را با خط نمایش می دهند. [ ۱] [ ۲] در این ساختار بار قراردادی نیز نمایش داده می شود. [ ۱] این فرمول را به پاس گیلبرت نیوتون لوویس، دانشمند آمریکایی که در سال ۱۹۱۶ نظریه پیوند کووالانسی را ارائه داد، لوویس نامیدند. [ ۲] . . . .
برای رسم انواع ساختار لوویس از الگوریتم داده شده استفاده می کنیم. [ ۳] مراحل باید به ترتیب طی شوند.
۱. تعیین اتم مرکزی:
در ساختار لوویس اتمی را که ۳ شرط زیر را داشته باشد اتم مرکزی می نامیم و دیگر اتم ها را اتم اطراف می نامیم.
• اتمی که کمترین تعداد را داشته باشد واگر تعدادها برابر بود:
• اتمی که در لایه ظرفیت خود اوربیتال تک الکترونی بیشتری داشته باشد و اگر تعداد آنها نیز برابر بود:
• اتمی که الکترونگاتیوی آن از بقیه اتم ها کمتر باشد.
•
• در ساختار لوویس، هر مولکول یا یون هر اتمی که اتم مرکزی نباشد، اتم اطراف نام می گیرد.
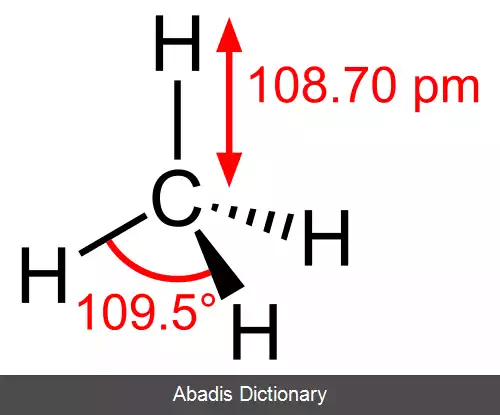
برای نمونه، در تترا کلرو متان یا کربن تترا کلرید ( CCl۴ ) اتم مرکزی C و اتم های اطراف Clها هستند.
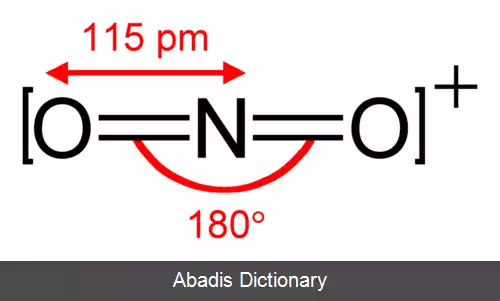
در مورد ۱ استثناً در مولکول N۲O یکی از نیتروژن ها اتم مرکزی است.
• هیدروژن هیچگاه اتم مرکزی نخواهد بود
مثال:
۲. دانستن آرایش الکترونی لایه ظرفیت ( والانس ) اتم مرکزی و محاسبه تعداد اوربیتال نیمه پر آن:
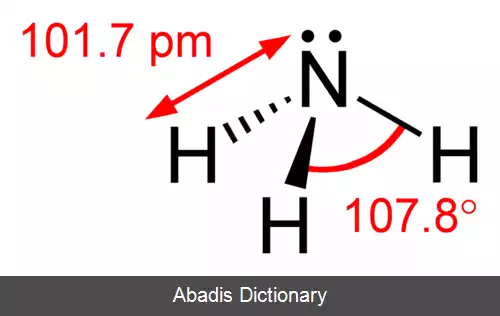
• مثال: N ( نیتروژن ) در گروه ۱۵ جای دارد و به آرایش الکترونی ns2 np3 ختم می شود پس ۳ اوربیتال نیمه پر دارد.
۳. تعیین اینکه آیا اتم مرکزی می تواند برانگیخته شود یا خیر؟
•
• مفهوم بر انگیختگی در رسم ساختار لوویس یعنی توانایی تبدیل اوربیتال پر به نیمه پر با جابه جایی الکترون در هر لایه.
• مثال: تبدیل ns2 np2 به ns1 np3 یا تبدیل ns2 np3 به ns1 np3 ( n - 1 ) d1
۴. آیا اتم مرکزی نیازی به برانگیخته شدن دارد یا خیر؟
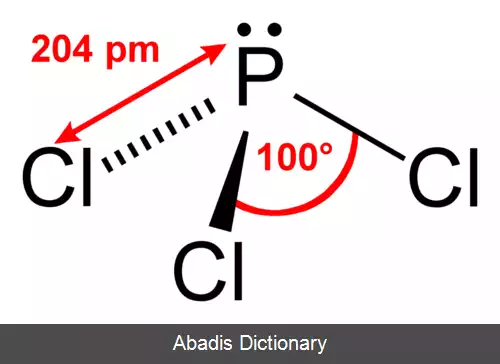
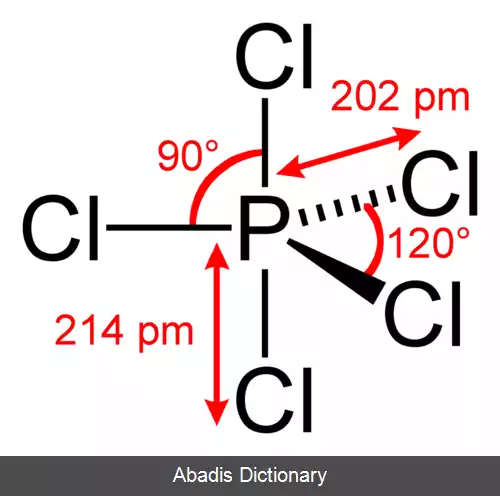
• در حالت کلی عنصر موقعی برانگیخته می شود که نیاز به اوربیتال نیمه پر اضافه تر باشد برای مثال در ساختار PCl3 نیازی به برانگیخته شدن نیست چون به تعداد کافی اوربیتال نیمه پر برای اتم های اطراف وجود داردولی در مورد PCl5 اوربیتال نیمه پر برای اتم های اطراف کافی نیست نیاز به برانگیخته شدن وجود دارد.
•
• ساختار P در ns2 np3 = PCl3
• ساختار P در ns1 np3 ( n - 1 ) d1 = PCl5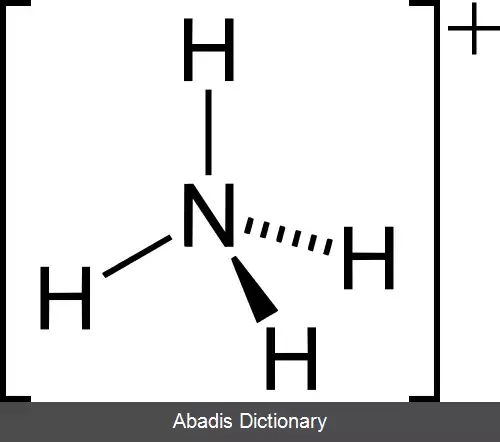
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفبرای رسم انواع ساختار لوویس از الگوریتم داده شده استفاده می کنیم. [ ۳] مراحل باید به ترتیب طی شوند.
۱. تعیین اتم مرکزی:
در ساختار لوویس اتمی را که ۳ شرط زیر را داشته باشد اتم مرکزی می نامیم و دیگر اتم ها را اتم اطراف می نامیم.
• اتمی که کمترین تعداد را داشته باشد واگر تعدادها برابر بود:
• اتمی که در لایه ظرفیت خود اوربیتال تک الکترونی بیشتری داشته باشد و اگر تعداد آنها نیز برابر بود:
• اتمی که الکترونگاتیوی آن از بقیه اتم ها کمتر باشد.
•
• در ساختار لوویس، هر مولکول یا یون هر اتمی که اتم مرکزی نباشد، اتم اطراف نام می گیرد.
برای نمونه، در تترا کلرو متان یا کربن تترا کلرید ( CCl۴ ) اتم مرکزی C و اتم های اطراف Clها هستند.
در مورد ۱ استثناً در مولکول N۲O یکی از نیتروژن ها اتم مرکزی است.
• هیدروژن هیچگاه اتم مرکزی نخواهد بود
مثال:
۲. دانستن آرایش الکترونی لایه ظرفیت ( والانس ) اتم مرکزی و محاسبه تعداد اوربیتال نیمه پر آن:
• مثال: N ( نیتروژن ) در گروه ۱۵ جای دارد و به آرایش الکترونی ns2 np3 ختم می شود پس ۳ اوربیتال نیمه پر دارد.
۳. تعیین اینکه آیا اتم مرکزی می تواند برانگیخته شود یا خیر؟
•
• مفهوم بر انگیختگی در رسم ساختار لوویس یعنی توانایی تبدیل اوربیتال پر به نیمه پر با جابه جایی الکترون در هر لایه.
• مثال: تبدیل ns2 np2 به ns1 np3 یا تبدیل ns2 np3 به ns1 np3 ( n - 1 ) d1
۴. آیا اتم مرکزی نیازی به برانگیخته شدن دارد یا خیر؟
• در حالت کلی عنصر موقعی برانگیخته می شود که نیاز به اوربیتال نیمه پر اضافه تر باشد برای مثال در ساختار PCl3 نیازی به برانگیخته شدن نیست چون به تعداد کافی اوربیتال نیمه پر برای اتم های اطراف وجود داردولی در مورد PCl5 اوربیتال نیمه پر برای اتم های اطراف کافی نیست نیاز به برانگیخته شدن وجود دارد.
•
• ساختار P در ns2 np3 = PCl3
• ساختار P در ns1 np3 ( n - 1 ) d1 = PCl5






wiki: ساختار لوویس
