ساختار دوم پروتئین، شکل سه بعدی بخش های محلی پروتئین ها است. دو عنصر ساختاری متداول در ساختار دوم متداول، مارپیچ های آلفا و صفحات بتا هستند، اگرچه چرخش های بتا و حلقه های امگا نیز رخ می دهند. عناصر ساختار دوم معمولاً به طور خودبه خودی به عنوان یک واسطهٔ پیش از تا شدن پروتئین به ساختار سه بعدی خود تشکیل می ڨشوند.
ساختار دوم به طور رسمی با الگوی پیوندهای هیدروژنی بین اتم های آمینه هیدروژن و اکسیژن کربوکسیل در ساختاری پپتیدی تعریف می شود. مفهوم ساختار دوم پروتئین، نخستین بار توسط Kaj Ulrik Linderstrøm - Lang در استنفورد در سال ۱۹۵۲ معرفی شد. [ ۱] انواع دیگر بیوپلیمرها مانند اسیدهای نوکلئیک نیز ساختارهای دوم مشخصی دارند. [ ۲]
رایج ترین ساختارهای ثانویه، مارپیچ آلفا و صفحات بتا هستند. سایر مارپیچ ها، مانند مارپیچ π، از نظر انرژی دارای الگوهای پیوند هیدروژنی مطلوبی هستند، اما به ندرت در پروتئین های طبیعی مشاهده می شوند.
پیش بینی ساختار سوم پروتئین، تنها از روی توالی آمینه آن یک مشکل بسیار چالش برانگیز است اما استفاده از تعاریف ساده تر ساختار دوم قابل حل تر است.
ساختار دوم پروتئین و اسیدهای نوکلئیک می توانند برای کمک به هم ترازسازی چند توالی استفاده شوند. این ترازها را می توان با گنجاندن اطلاعات ساختار دوم، علاوه بر اطلاعات توالی ساده، دقیق تر کرد. گاهی می توان روابط دور بین پروتئین هایی را که ساختار اولیهٔ آن ها ناهم تراز است، توسط ساختار دوم یافت. [ ۳]
نشان داده شده است که مارپیچ های آلفا پایدارتر، در برابر جهش ها مقاوم تر و قابل طراحی تر از رشته های بتا در پروتئین های طبیعی هستند، [ ۴] بنابراین طراحی پروتئین های عملکردی all - a احتمالاً آسان تر از طراحی پروتئین هایی با مارپیچ و رشته است. این موضوع، اخیراً به صورت تجربی تأیید شده است. [ ۵]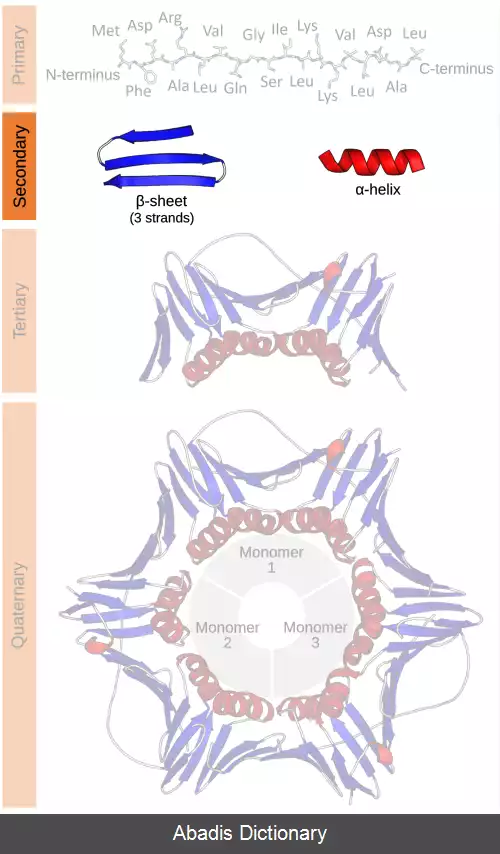
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفساختار دوم به طور رسمی با الگوی پیوندهای هیدروژنی بین اتم های آمینه هیدروژن و اکسیژن کربوکسیل در ساختاری پپتیدی تعریف می شود. مفهوم ساختار دوم پروتئین، نخستین بار توسط Kaj Ulrik Linderstrøm - Lang در استنفورد در سال ۱۹۵۲ معرفی شد. [ ۱] انواع دیگر بیوپلیمرها مانند اسیدهای نوکلئیک نیز ساختارهای دوم مشخصی دارند. [ ۲]
رایج ترین ساختارهای ثانویه، مارپیچ آلفا و صفحات بتا هستند. سایر مارپیچ ها، مانند مارپیچ π، از نظر انرژی دارای الگوهای پیوند هیدروژنی مطلوبی هستند، اما به ندرت در پروتئین های طبیعی مشاهده می شوند.
پیش بینی ساختار سوم پروتئین، تنها از روی توالی آمینه آن یک مشکل بسیار چالش برانگیز است اما استفاده از تعاریف ساده تر ساختار دوم قابل حل تر است.
ساختار دوم پروتئین و اسیدهای نوکلئیک می توانند برای کمک به هم ترازسازی چند توالی استفاده شوند. این ترازها را می توان با گنجاندن اطلاعات ساختار دوم، علاوه بر اطلاعات توالی ساده، دقیق تر کرد. گاهی می توان روابط دور بین پروتئین هایی را که ساختار اولیهٔ آن ها ناهم تراز است، توسط ساختار دوم یافت. [ ۳]
نشان داده شده است که مارپیچ های آلفا پایدارتر، در برابر جهش ها مقاوم تر و قابل طراحی تر از رشته های بتا در پروتئین های طبیعی هستند، [ ۴] بنابراین طراحی پروتئین های عملکردی all - a احتمالاً آسان تر از طراحی پروتئین هایی با مارپیچ و رشته است. این موضوع، اخیراً به صورت تجربی تأیید شده است. [ ۵]

wiki: ساختار دوم پروتئین
