تعادل حلالیت نوعی از تعادل دینامیکی است و زمانی وجود دارد که یک ترکیب شیمیایی در حالت جامد با محلول آن ترکیب در تعادل شیمیایی باشد. جامد ممکن است بدون تغییر، با تفکیک، یا با واکنش شیمیایی با ترکیب دیگری از محلول، مانند اسید یا قلیا، حل شود. تعادل حلالیت در شاخه های دارویی، زیست محیطی و بسیاری از شاخه های دیگر مهم است.
تعادل حلالیت زمانی وجود دارد که یک ترکیب شیمیایی در حالت جامد با محلولی حاوی ترکیب در تعادل شیمیایی باشد. این نوع تعادل، نمونه ای از تعادل دینامیکی است که برخی از مولکول های منفرد بین فاز جامد و محلول حرکت می کنند به طوری که سرعت انحلال و تشکیل رسوب ( ته نشینی ) با یکدیگر برابر است. هنگامی که تعادل برقرار شود و همه جامد حل نشده باشد، محلول اشباع شده است. غلظت حل شونده در یک محلول اشباع به عنوان انحلال پذیری شناخته می شود. میزان انحلال پذیری به دما وابسته است. محلولی که دارای غلظت حل شونده بالاتر از میزان انحلال پذیری باشد، محلول فوق اشباع گفته می شود.
یک محلول فوق اشباع ممکن است با افزودن یک «دانه» که ممکن است یک کریستال ریز از حل شونده یا یک ذره جامد کوچک باشد که رسوب را آغاز می کند، به تعادل برسد.
سه نوع اصلی تعادل حلالیت وجود دارد:
• انحلال ساده
• انحلال با واکنش تجزیه. این ویژگی نمک ها است. ثابت تعادل در این مورد به عنوان یک محصول حلالیت شناخته می شود.
• انحلال با واکنش یونیزاسیون این مشخصه انحلال اسیدهای ضعیف یا بازهای ضعیف در محیط های آبی با pH متغیر است
در هر یک از موارد بالا، یک ثابت تعادل را می توان به عنوان ضریبی برای فعالیت ها مشخص کرد. این ثابت تعادل کمیت بدون بعد است زیرا فعالیت یک کمیت بدون بعد است. با این وجود، ثابت تعادل معمولاً بر ضرایب فعالیت تقسیم می شود تا به یک ضریب غلظت تبدیل شود. علاوه بر این، فعالیت یک جامد، طبق تعریف، برابر با ۱ است، بنابراین از عبارت تعریف حذف شده است.
برای یک تعادل شیمیایی داریم:
A p B q ⇋ p A + q B
فرآورده انحلال پذیری ( Ksp ) برای ترکیب ( ApBq ) ، به صورت زیر تعریف می شود:
K s p = p q
که در آن و ، غلظت های A و B در یک محلول اشباع هستند.
حلالیت به تغییرات دما حساس است. به عنوان مثال شکر در آب گرم بیشتر از آب سرد حل می شود. این به این دلیل رخ می دهد که فرآورده انحلال، مانند انواع دیگر ثابت های تعادل، تابع دما هستند. مطابق با اصل لوشاتلیه، زمانی که فرایند انحلال گرماگیر است ( گرما جذب می کند ) ، انحلال پذیری با افزایش دما افزایش می یابد. این اثر اساس فرایند تبلور مجدد است که می تواند برای خالص سازی یک ترکیب شیمیایی استفاده شود. هنگامی که انحلال گرمازا است ( گرما آزاد می شود ) انحلال پذیری با افزایش دما کاهش می یابد. سولفات سدیم در دمای کمتر از حدود ۳۲٫۴ درجه سانتی گراد همراه با افزایش انحلال پذیری است، اما در دمای بالاتر انحلال پذیری کاهش می یابد.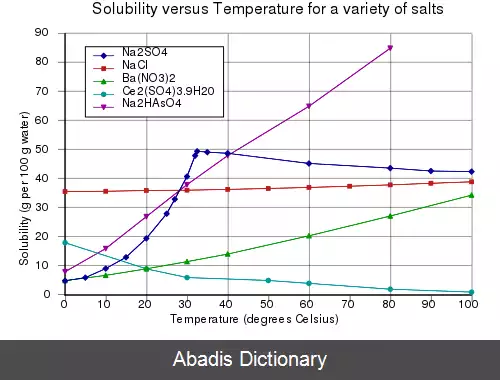
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفتعادل حلالیت زمانی وجود دارد که یک ترکیب شیمیایی در حالت جامد با محلولی حاوی ترکیب در تعادل شیمیایی باشد. این نوع تعادل، نمونه ای از تعادل دینامیکی است که برخی از مولکول های منفرد بین فاز جامد و محلول حرکت می کنند به طوری که سرعت انحلال و تشکیل رسوب ( ته نشینی ) با یکدیگر برابر است. هنگامی که تعادل برقرار شود و همه جامد حل نشده باشد، محلول اشباع شده است. غلظت حل شونده در یک محلول اشباع به عنوان انحلال پذیری شناخته می شود. میزان انحلال پذیری به دما وابسته است. محلولی که دارای غلظت حل شونده بالاتر از میزان انحلال پذیری باشد، محلول فوق اشباع گفته می شود.
یک محلول فوق اشباع ممکن است با افزودن یک «دانه» که ممکن است یک کریستال ریز از حل شونده یا یک ذره جامد کوچک باشد که رسوب را آغاز می کند، به تعادل برسد.
سه نوع اصلی تعادل حلالیت وجود دارد:
• انحلال ساده
• انحلال با واکنش تجزیه. این ویژگی نمک ها است. ثابت تعادل در این مورد به عنوان یک محصول حلالیت شناخته می شود.
• انحلال با واکنش یونیزاسیون این مشخصه انحلال اسیدهای ضعیف یا بازهای ضعیف در محیط های آبی با pH متغیر است
در هر یک از موارد بالا، یک ثابت تعادل را می توان به عنوان ضریبی برای فعالیت ها مشخص کرد. این ثابت تعادل کمیت بدون بعد است زیرا فعالیت یک کمیت بدون بعد است. با این وجود، ثابت تعادل معمولاً بر ضرایب فعالیت تقسیم می شود تا به یک ضریب غلظت تبدیل شود. علاوه بر این، فعالیت یک جامد، طبق تعریف، برابر با ۱ است، بنابراین از عبارت تعریف حذف شده است.
برای یک تعادل شیمیایی داریم:
A p B q ⇋ p A + q B
فرآورده انحلال پذیری ( Ksp ) برای ترکیب ( ApBq ) ، به صورت زیر تعریف می شود:
K s p = p q
که در آن و ، غلظت های A و B در یک محلول اشباع هستند.
حلالیت به تغییرات دما حساس است. به عنوان مثال شکر در آب گرم بیشتر از آب سرد حل می شود. این به این دلیل رخ می دهد که فرآورده انحلال، مانند انواع دیگر ثابت های تعادل، تابع دما هستند. مطابق با اصل لوشاتلیه، زمانی که فرایند انحلال گرماگیر است ( گرما جذب می کند ) ، انحلال پذیری با افزایش دما افزایش می یابد. این اثر اساس فرایند تبلور مجدد است که می تواند برای خالص سازی یک ترکیب شیمیایی استفاده شود. هنگامی که انحلال گرمازا است ( گرما آزاد می شود ) انحلال پذیری با افزایش دما کاهش می یابد. سولفات سدیم در دمای کمتر از حدود ۳۲٫۴ درجه سانتی گراد همراه با افزایش انحلال پذیری است، اما در دمای بالاتر انحلال پذیری کاهش می یابد.


wiki: تعادل حلالیت
