در شیمی، ارتوسیلیکات آنیون SiO4−4 یا هر یک از نمک ها و استرهای آن است. ارتوسیلیکات یکی از آنیون های سیلیکات است که گاهی اوقات آنیون یا گروه تتروکسید سیلیکون نامیده می شود. [ ۱]
نمک های ارتوسیلیکات مانند ارتوسیلیکات سدیم پایدار هستند و به طور گسترده ای در طبیعت به عنوان کانی های سیلیکات یافت می شوند و ویژگی بارزنزوسیلیکات ها هستند. [ ۲] الیوین، یک ارتوسیلیکات منیزیم یا آهن ( II ) ، فراوان ترین ماده معدنی در گوشته بالاییاست.
آنیون ارتوسیلیکات یک باز قوی است، باز مزدوج اسید اورتوسیلیک H4SiO4 ( p K a2 = ۱۳٫۲ در 25 درجه سانتی گراد ) بسیار ضعیف است. بررسی این تعادل دشوار است زیرا اسید تمایل دارد به میعان سیلیکا هیدرات تجزیه شود. [ ۳]
یون یا گروه ارتوسیلیکات دارای شکل چهار وجهی است که یک اتم سیلیکون توسط چهار اتم اکسیژن احاطه شده است.
در آنیون، هر اکسیژن یک واحد بار منفی را حمل می کند. طول پیوند Si - O 162 است.
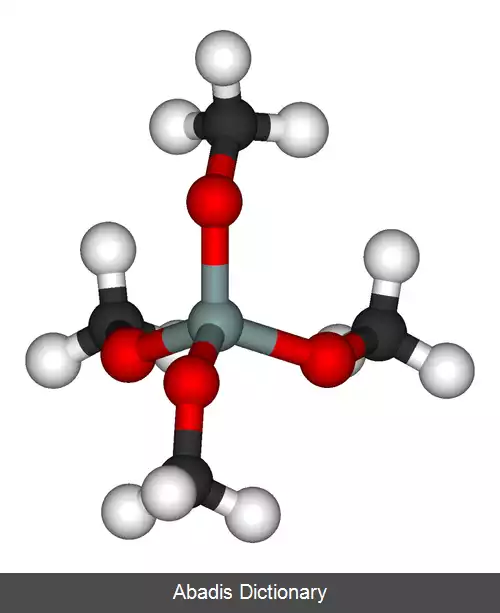
در ترکیبات آلی مانند تترا متیل ارتوسیلیکات، هر اکسیژن به طور رسمی خنثی است و توسط یک پیوند کووالانسی به بقیه مولکول متصل است.
اروپیم دوپ شده با باریم اورتوسیلیکات ( Ba2SiO4 ) یک فسفر مشترک است که در LED سبز به کار می رود. فسفر برای LEDهای آبی را می توان با ارتوسیلیکات باریم دوپ شده با استرانسیوم ساخت. [ ۴] باریم ارتوسیلیکات عامل اصلی مسمومیت با کاتد در لوله های خلاء است.
اگرچه در شیمی معدنی و ژئوشیمی بسیار مهم است، یون ارتوسیلیکات به ندرت در شیمی آلی دیده می شود. با این حال، دو ترکیب سیلیکات در سنتز آلی استفاده می شود: تترا اتیل ارتوسیلیکات یا TEOS برای پیوند پلیمرها استفاده می شود و به ویژه در ساخت آئروژل ها اهمیت دارد. تترا متیل اورتوسیلیکات یا TMOS به عنوان یک جایگزین برای TEOS استفاده می شود، و همچنین دارای تعدادی از استفاده های دیگر به عنوان یک واکنشگر. TEOS بر TMOS ترجیح داده می شود زیرا TMOS تجزیه می شود تا غلظت بالایی از متانول سمی تولید کند. استنشاق TMOS می تواند منجر به تجمع سمی سیلیس در ریه ها شود.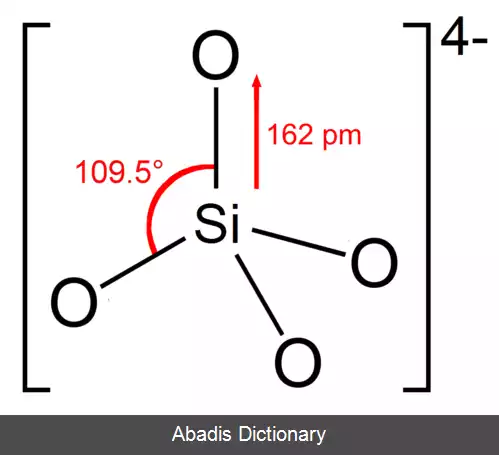
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفنمک های ارتوسیلیکات مانند ارتوسیلیکات سدیم پایدار هستند و به طور گسترده ای در طبیعت به عنوان کانی های سیلیکات یافت می شوند و ویژگی بارزنزوسیلیکات ها هستند. [ ۲] الیوین، یک ارتوسیلیکات منیزیم یا آهن ( II ) ، فراوان ترین ماده معدنی در گوشته بالاییاست.
آنیون ارتوسیلیکات یک باز قوی است، باز مزدوج اسید اورتوسیلیک H4SiO4 ( p K a2 = ۱۳٫۲ در 25 درجه سانتی گراد ) بسیار ضعیف است. بررسی این تعادل دشوار است زیرا اسید تمایل دارد به میعان سیلیکا هیدرات تجزیه شود. [ ۳]
یون یا گروه ارتوسیلیکات دارای شکل چهار وجهی است که یک اتم سیلیکون توسط چهار اتم اکسیژن احاطه شده است.
در آنیون، هر اکسیژن یک واحد بار منفی را حمل می کند. طول پیوند Si - O 162 است.
در ترکیبات آلی مانند تترا متیل ارتوسیلیکات، هر اکسیژن به طور رسمی خنثی است و توسط یک پیوند کووالانسی به بقیه مولکول متصل است.
اروپیم دوپ شده با باریم اورتوسیلیکات ( Ba2SiO4 ) یک فسفر مشترک است که در LED سبز به کار می رود. فسفر برای LEDهای آبی را می توان با ارتوسیلیکات باریم دوپ شده با استرانسیوم ساخت. [ ۴] باریم ارتوسیلیکات عامل اصلی مسمومیت با کاتد در لوله های خلاء است.
اگرچه در شیمی معدنی و ژئوشیمی بسیار مهم است، یون ارتوسیلیکات به ندرت در شیمی آلی دیده می شود. با این حال، دو ترکیب سیلیکات در سنتز آلی استفاده می شود: تترا اتیل ارتوسیلیکات یا TEOS برای پیوند پلیمرها استفاده می شود و به ویژه در ساخت آئروژل ها اهمیت دارد. تترا متیل اورتوسیلیکات یا TMOS به عنوان یک جایگزین برای TEOS استفاده می شود، و همچنین دارای تعدادی از استفاده های دیگر به عنوان یک واکنشگر. TEOS بر TMOS ترجیح داده می شود زیرا TMOS تجزیه می شود تا غلظت بالایی از متانول سمی تولید کند. استنشاق TMOS می تواند منجر به تجمع سمی سیلیس در ریه ها شود.


wiki: ارتوسیلیکات
