پیش بینی ساختار پروتئین به معنای استنتاج ساختار سه بعدی پروتئین از روی دنباله آمینواسیدهای آن یا به بیان دیگر، تعیین ساختار دوم و سوم از روی ساختار اولیهٔ پروتئین است. تعیین ساختار پروتئین از مبنا با مسئلهٔ طراحی یک پروتئین متفاوت است. تعیین ساختار پروتئین یکی از مسائل مهم در حوزه بیوانفورماتیک و شیمی تئوری است و اهمیت زیادی در پزشکی ( برای مثال در طراحی دارو ) و زیست فناوری ( در طراحی آنزیم ها ) دارد.
پروتئین ها زنجیره ای از آمینواسیدها هستند که به وسیلهٔ پیوندهای پپتیدی به یکدیگر متصل شده اند. شکل های متفاوتی از این زنجیره ( با چرخش در اطراف کربن آلفا ) در فضای سه بعدی امکان پذیر است. برخی آمینواسیدها ساختار قطبی دارند و دارای دو ناحیهٔ مجزای مثبت و منفی با یک گروه آزاد C=O و یک گروه آزاد NH هستند. این دو گروه در ساختار پروتئین تشکیل پیوند هیدروژنی می دهند. ۲۰ نوع آمینو اسید موجود را می تواند برمبنای ساختار شیمیایی زنجیره جانبی تقسیم بندی نمود. برای مثال، گلیسین کوچکترین زنجیره جانبی را که تنها شامل یک اتم هیدروژن است، دارد و بنابراین انعطاف بالایی در شکل گیری ساختارهای محلی پروتئین ایجاد می کند.
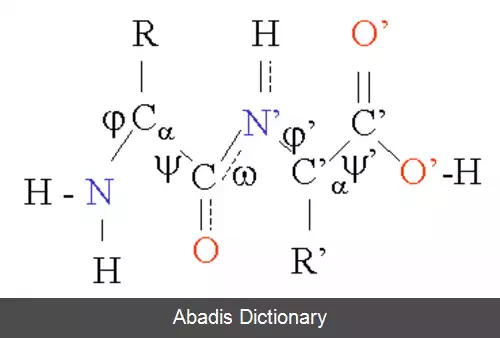
ساختار پروتئین را می توان به صورت دنباله ای از اجزای ساختار دوم، حلقه های آلفا و صفحات بتا، در نظر گرفت. در ساختار دوم، الگوهای منظمی از پیوندهای هیدروژنی بین آمینواسیدهای همسایه شکل می گیرد و آمینواسیدها دارای زوایای فی ( زاویه حول نیتروژن و کربن آلفا ) و سای ( زاویه حول پیوند کربن آلفا و کربن کربونیل ) یکسانی هستند.
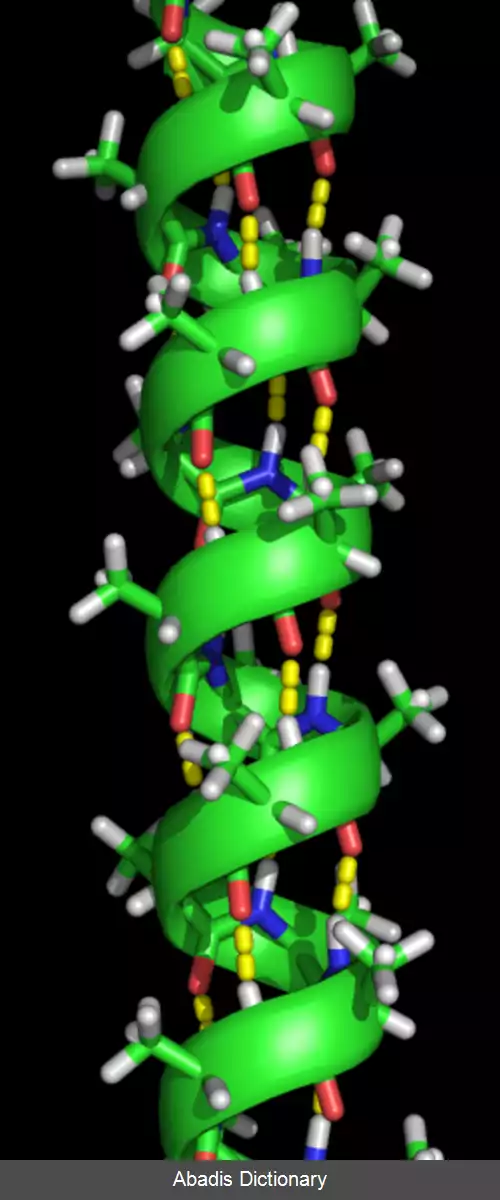
مارپیچ آلفا پر تکرارترین نوع از اجزای ساختار دوم در پروتئین ها است که در هر دور به طور متوسط ۳٫۶ آمینواسید دارد. یک پیوند هیدروژنی نیز در انتهای دور چهارم ایجاد می شود. طول متوسط هر مارپیچ ۳ دور ( معادل با ۱۰ آمینواسید ) است. این طول از ۱٫۵ تا ۱۱ دور ( ۵ تا ۴۰ آمینواسید ) متغیر است. هم ترازی پیوندهای هیدروژنی یک گشتاور دوقطبی را در مارپیچ ایجاد می کند و منجر به ایجاد یک بار مثبت جزئی در آمینواسید انتهای مارپیچ می شود. از آنجا که این ناحیه دارای گروه آزاد NH است، با یک گروه با بار منفی مانند فسفات تعامل دارد. معمول ترین مکان برای مارپیچ آلفا سطح هسته های پروتئین است که یک رابط را برای تعامل با محیط آبی بیرون ایجاد می کند. قسمت داخلی مارپیچ تمایل به داشتن آمینواسیدهای آب گریز و قسمت بیرون تمایل به داشتن آمینواسیدهای آب دوست دارد؛ بنابراین در طول مارپیچ از هر چهار آمینواسید، سه آمینواسید آب گریز خواهند بود. سایر آمینواسیدهای موجود در هسته پروتئین یا داخل غشای سلولی خاصیت آب گریزی دارند. به طور کلی مارپیچ های قرار گرفته در سطح، تعداد کم تری آمینواسید آب گریز دارند. از این ویژگی می توان در پیش بینی ساختار پروتئین ها کمک گرفت. برای مثال نواحی با مقادیر بیشتر از آلانین، گلوتامین اسید، لوسین و متیونین و مقادیر کمتر از پرولین، گلیسین، تیروزین و سرین تمایل به تشکیل مارپیچ آلفا دارند.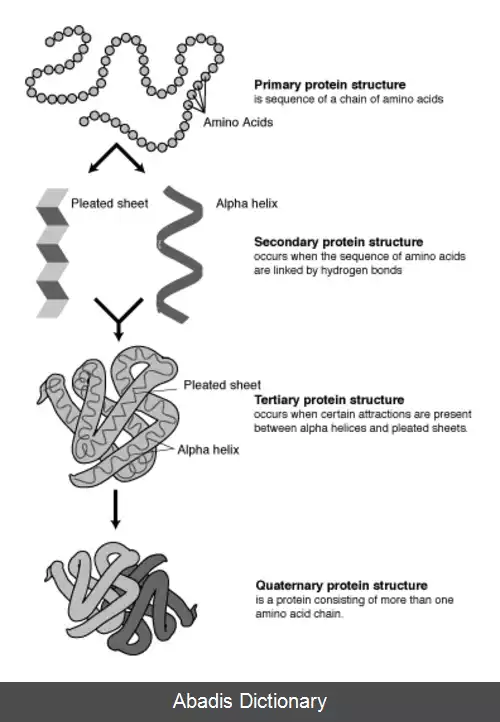
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفپروتئین ها زنجیره ای از آمینواسیدها هستند که به وسیلهٔ پیوندهای پپتیدی به یکدیگر متصل شده اند. شکل های متفاوتی از این زنجیره ( با چرخش در اطراف کربن آلفا ) در فضای سه بعدی امکان پذیر است. برخی آمینواسیدها ساختار قطبی دارند و دارای دو ناحیهٔ مجزای مثبت و منفی با یک گروه آزاد C=O و یک گروه آزاد NH هستند. این دو گروه در ساختار پروتئین تشکیل پیوند هیدروژنی می دهند. ۲۰ نوع آمینو اسید موجود را می تواند برمبنای ساختار شیمیایی زنجیره جانبی تقسیم بندی نمود. برای مثال، گلیسین کوچکترین زنجیره جانبی را که تنها شامل یک اتم هیدروژن است، دارد و بنابراین انعطاف بالایی در شکل گیری ساختارهای محلی پروتئین ایجاد می کند.
ساختار پروتئین را می توان به صورت دنباله ای از اجزای ساختار دوم، حلقه های آلفا و صفحات بتا، در نظر گرفت. در ساختار دوم، الگوهای منظمی از پیوندهای هیدروژنی بین آمینواسیدهای همسایه شکل می گیرد و آمینواسیدها دارای زوایای فی ( زاویه حول نیتروژن و کربن آلفا ) و سای ( زاویه حول پیوند کربن آلفا و کربن کربونیل ) یکسانی هستند.
مارپیچ آلفا پر تکرارترین نوع از اجزای ساختار دوم در پروتئین ها است که در هر دور به طور متوسط ۳٫۶ آمینواسید دارد. یک پیوند هیدروژنی نیز در انتهای دور چهارم ایجاد می شود. طول متوسط هر مارپیچ ۳ دور ( معادل با ۱۰ آمینواسید ) است. این طول از ۱٫۵ تا ۱۱ دور ( ۵ تا ۴۰ آمینواسید ) متغیر است. هم ترازی پیوندهای هیدروژنی یک گشتاور دوقطبی را در مارپیچ ایجاد می کند و منجر به ایجاد یک بار مثبت جزئی در آمینواسید انتهای مارپیچ می شود. از آنجا که این ناحیه دارای گروه آزاد NH است، با یک گروه با بار منفی مانند فسفات تعامل دارد. معمول ترین مکان برای مارپیچ آلفا سطح هسته های پروتئین است که یک رابط را برای تعامل با محیط آبی بیرون ایجاد می کند. قسمت داخلی مارپیچ تمایل به داشتن آمینواسیدهای آب گریز و قسمت بیرون تمایل به داشتن آمینواسیدهای آب دوست دارد؛ بنابراین در طول مارپیچ از هر چهار آمینواسید، سه آمینواسید آب گریز خواهند بود. سایر آمینواسیدهای موجود در هسته پروتئین یا داخل غشای سلولی خاصیت آب گریزی دارند. به طور کلی مارپیچ های قرار گرفته در سطح، تعداد کم تری آمینواسید آب گریز دارند. از این ویژگی می توان در پیش بینی ساختار پروتئین ها کمک گرفت. برای مثال نواحی با مقادیر بیشتر از آلانین، گلوتامین اسید، لوسین و متیونین و مقادیر کمتر از پرولین، گلیسین، تیروزین و سرین تمایل به تشکیل مارپیچ آلفا دارند.



wiki: پیش بینی ساختار پروتئین
