پلی سیلان ها ترکیبات آلی سیلیسی با فرمول ( R 2 Si ) n هستند. این پلمیرها از دسته پلیمرهای آلی سنتی هستند که در ساختار اصلی آنها اتم های سیلسیم وجود دارد. از جمله ویژگی این نوع پلمیرها، خواص نوری و الکتریکی متمایز است. پلی سیلان ها عمدتاً به عنوان پیش سازهای کاربید سیلیکون هم مورد استفاده قرار می گیرند. ساده ترین پلی سیلان ( SiH2 ) n است که عمدتاً جنبه نظری دارد. [ ۱]
اولین پلی سیلان، پلی ( دی متیل سیلیلن ) ، x، در سال ۱۹۴۹ توسط چارلز ا. بورکهارد از جنرال الکتریک گزارش شد که از حرارت دادن فلز سدیم با دی متیل دی کلروسیلان بدست می آمد:
واکنش اصلاح شده جفت شدن ورتز دی کلروسیلان ها، یک مسیر قابل دوام و عمومی برای رسیدن به مشتقات پلی سیلان خطی با توزین مولکولی بالاست. [ ۲] این واکنش در دمای بالا در یک حلال بی اثر با استفاده از پراکندگی فلز قلیایی انجام می شود. واکنش پلیمره شدن با افزودن یک الکل متوقف می شود. محدودیت اصلی پلیمریزاسیون نوع ورتز این است که جانشین ها باید شرایط واکنش شدید را تحمل کنند. این واکنش برای جایگزین های متیل، بنزیل و فنیل به خوبی کار می کند. [ ۳] با شرایط سخت، بازده محصول از چند درصد تا تقریباً ۵۰ درصد متغیر است. به طور مشابه، گرافیت پتاسیم ( KC 8 ) را می توان در دماهای بسیار پایین تر از دمای مورد نیاز برای کوپلینگ سنتی ورتز استفاده کرد. [ ۴] این واکنش معمولاً یک توزیع سه وجهی از محصولات ایجاد می کند: یک کسر با وزن مولکولی کم و دو کسر با وزن مولکولی بالاتر. کسر با وزن مولکولی کم از حلقه های پنج و شش عضوی تشکیل شده است، یعنی 5 و 6. تشکیل این حلقه ها با رشد پلیمر رقابت می کند. [ ۴] یکی دیگر از روش های سنتز پلی سیلان ها، جفت گیری هیدروژنی سیلان ها است.
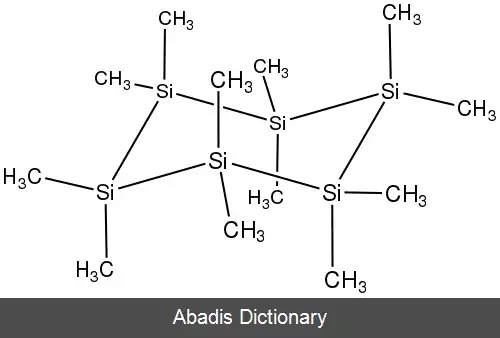
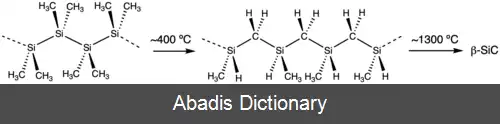
محصول به دست آمده توسط بورکهارد به دلیل نامحلول بودن در حلال های آلی کار دشواری بود. علاقه به پلی سیلان ها در اوایل دهه ۱۹۸۰ از سر گرفته شد، زمانی که گزارش شد که x می تواند با ترمولیز به کاربید سیلیکون تبدیل شود.
شکل های پلی سیلان ها از مواد بسیار کریستالی ( و به طور کلی نامحلول ) تا مواد آمورف، که در حلال های آلی محلول تر هستند، متغیر است. کاهش تقارن و طولانی شدن جایگزین های آلی، بلورینگی را کاهش می دهد. بسیاری از پلی سیلان ها الاستومر های لاستیکی هستند. هنگامی که با عوامل اکسید کننده ( SbF 5، ید، FeCl 3، فروسن ) دوپ شوند، پلیمرها به نیمه رسانا تبدیل می شوند. اکثر آنها تا نزدیک به300 °C پایدار هستند و بر خلاف هیدریدهای پلی سیلیکون، در دمای معمولی نسبت به اکسیژن بی اثر هستند. آنها به راحتی هیدرولیز نمی شوند. پلی سیلان ها رسانایی نوری از خود نشان می دهند. اگرچه در مواجهه با نور فرابنفش تخریب می شوند. [ ۳] اتم های هیدروژن هیدریدهای پلی سیلیکون با ابعاد بالاتر نیز ممکن است با گروه های جانبی آلی جایگزین شوند تا پلیمرهای ارگانوسیلیکن شبکه تصادفی به دست آورند، اما نام پایه پلی سیلین را حفظ می کنند، برای مثال، پلی متیل سیلین. 29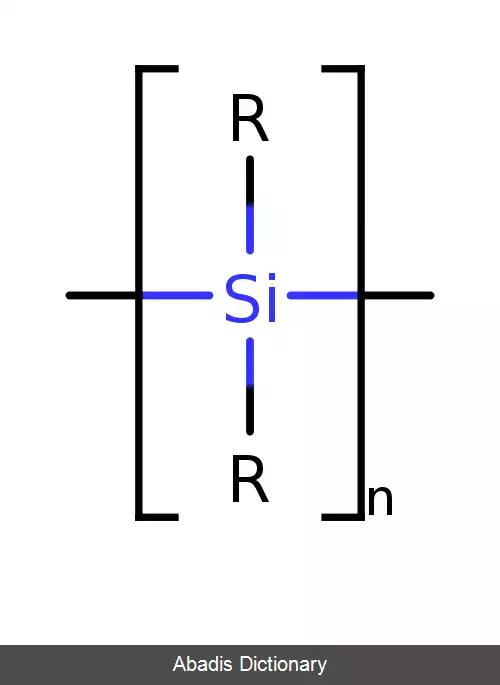
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاولین پلی سیلان، پلی ( دی متیل سیلیلن ) ، x، در سال ۱۹۴۹ توسط چارلز ا. بورکهارد از جنرال الکتریک گزارش شد که از حرارت دادن فلز سدیم با دی متیل دی کلروسیلان بدست می آمد:
واکنش اصلاح شده جفت شدن ورتز دی کلروسیلان ها، یک مسیر قابل دوام و عمومی برای رسیدن به مشتقات پلی سیلان خطی با توزین مولکولی بالاست. [ ۲] این واکنش در دمای بالا در یک حلال بی اثر با استفاده از پراکندگی فلز قلیایی انجام می شود. واکنش پلیمره شدن با افزودن یک الکل متوقف می شود. محدودیت اصلی پلیمریزاسیون نوع ورتز این است که جانشین ها باید شرایط واکنش شدید را تحمل کنند. این واکنش برای جایگزین های متیل، بنزیل و فنیل به خوبی کار می کند. [ ۳] با شرایط سخت، بازده محصول از چند درصد تا تقریباً ۵۰ درصد متغیر است. به طور مشابه، گرافیت پتاسیم ( KC 8 ) را می توان در دماهای بسیار پایین تر از دمای مورد نیاز برای کوپلینگ سنتی ورتز استفاده کرد. [ ۴] این واکنش معمولاً یک توزیع سه وجهی از محصولات ایجاد می کند: یک کسر با وزن مولکولی کم و دو کسر با وزن مولکولی بالاتر. کسر با وزن مولکولی کم از حلقه های پنج و شش عضوی تشکیل شده است، یعنی 5 و 6. تشکیل این حلقه ها با رشد پلیمر رقابت می کند. [ ۴] یکی دیگر از روش های سنتز پلی سیلان ها، جفت گیری هیدروژنی سیلان ها است.
محصول به دست آمده توسط بورکهارد به دلیل نامحلول بودن در حلال های آلی کار دشواری بود. علاقه به پلی سیلان ها در اوایل دهه ۱۹۸۰ از سر گرفته شد، زمانی که گزارش شد که x می تواند با ترمولیز به کاربید سیلیکون تبدیل شود.
شکل های پلی سیلان ها از مواد بسیار کریستالی ( و به طور کلی نامحلول ) تا مواد آمورف، که در حلال های آلی محلول تر هستند، متغیر است. کاهش تقارن و طولانی شدن جایگزین های آلی، بلورینگی را کاهش می دهد. بسیاری از پلی سیلان ها الاستومر های لاستیکی هستند. هنگامی که با عوامل اکسید کننده ( SbF 5، ید، FeCl 3، فروسن ) دوپ شوند، پلیمرها به نیمه رسانا تبدیل می شوند. اکثر آنها تا نزدیک به300 °C پایدار هستند و بر خلاف هیدریدهای پلی سیلیکون، در دمای معمولی نسبت به اکسیژن بی اثر هستند. آنها به راحتی هیدرولیز نمی شوند. پلی سیلان ها رسانایی نوری از خود نشان می دهند. اگرچه در مواجهه با نور فرابنفش تخریب می شوند. [ ۳] اتم های هیدروژن هیدریدهای پلی سیلیکون با ابعاد بالاتر نیز ممکن است با گروه های جانبی آلی جایگزین شوند تا پلیمرهای ارگانوسیلیکن شبکه تصادفی به دست آورند، اما نام پایه پلی سیلین را حفظ می کنند، برای مثال، پلی متیل سیلین. 29



wiki: پلی سیلان
