پلریکسافور ( انگلیسی: Plerixafor ) با نام تجاری موزوبیل یک محرک ایمنی است که جهت تحریک و به جریان انداختنِ سلول های بنیادی خونساز در جریان خون، در بیماران مبتلا به سرطان به کار می رود. سپس سلول های بنیادی را از خون جدا کرده و مجدداً به خودِ بیمار پیوند می زنند.
سازمان غذا و داروی آمریکا این دارو را در ۱۵ دسامبر ۲۰۰۸ تأیید کرد. [ ۱] در اروپا پلریکسافور در ۲۹ مه ۲۰۰۹ مورد پذیرش واقع شد[ ۲] و وزارت بهداشت کانادا آن را در ۸ دسامبر ۲۰۱۱ تأیید کرد. [ ۳]
به حرکت درآوردنِ سلول های بنیادی خونساز که یکی از مراحل مهم پیوند مغز استخوان است، معمولاً از طریقِ تجویز فاکتور محرک کلونی گرانولوسیت ( G - CSF ) انجام می شود. اما این روش در ۱۵ تا ۲۰٪ بیماران پاسخگو نیست. ترکیب فاکتور محرک کلونی گرانولوسیت با داروی پلریکسافور، تعداد افرادی را که با درمان پاسخ می دهند، افزایش داده و تعداد کافی از سلول های بنیادی خونساز را جهت پیوند، ایجاد می کند. [ ۴] این دارو جهت استفاده در بیماران لنفوم و مولتیپل میلوما تأیید شده است. [ ۵]
مطالعات جانوری نشان داده است که این دارو تراتوژن است و به همین سبب مصرف آن در دوران بارداری ممنوع است؛ مگر در برخی بیمارانی که در شرایط بحرانی قرار دارند. تمام خانم هایی که در سنین باروری قرار دارند، باید پیش از مصرف پلریکسافور از یکی از روش های پیشگیری از بارداری استفاده کنند. معلوم نیست که این دارو به درون شیر مادر ترشح می شود یا خیر. شیردهی در حین مصرف این دارو می بایست متوقف شود. [ ۵]
تهوع، اسهال و واکنش های موضعی در ۱۰٪ از دریافت کنندگان مشاهده می شود. مشکلات هاضمه، گیجی، سردرد و دردهای عضلانی هم نسبتاً شایع است. احتمال بروز حساسیت کمتر از ۱٪ است. بیشتر عوارض جانبی در کارآزمایی های بالینی خفیف و گذرا بوده اند. [ ۵] [ ۶]
یک عارضهٔ خطرناک این دارو، احتمال تحرک سلول های سرطانی و جابجایی آنها به نقاط دیگر است که در بیماران مبتلا به سرطان خون مشاهده شده است. [ ۲]
یک عارضهٔ بالقوه دیگر پلریکسافور، احتمال پارگی خودبخودی طحال است. نگرانی ها از این عارضه، از آنجا ناشی می شود که اولاً در مدل های حیوانی این دارو سبب بزرگ طحالی می شود و ثانیاً فاکتور محرک کلونی گرانولوسیت در موارد نادر می تواند منجر به پارگی طحال شود.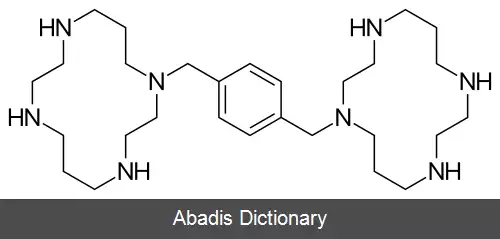
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفسازمان غذا و داروی آمریکا این دارو را در ۱۵ دسامبر ۲۰۰۸ تأیید کرد. [ ۱] در اروپا پلریکسافور در ۲۹ مه ۲۰۰۹ مورد پذیرش واقع شد[ ۲] و وزارت بهداشت کانادا آن را در ۸ دسامبر ۲۰۱۱ تأیید کرد. [ ۳]
به حرکت درآوردنِ سلول های بنیادی خونساز که یکی از مراحل مهم پیوند مغز استخوان است، معمولاً از طریقِ تجویز فاکتور محرک کلونی گرانولوسیت ( G - CSF ) انجام می شود. اما این روش در ۱۵ تا ۲۰٪ بیماران پاسخگو نیست. ترکیب فاکتور محرک کلونی گرانولوسیت با داروی پلریکسافور، تعداد افرادی را که با درمان پاسخ می دهند، افزایش داده و تعداد کافی از سلول های بنیادی خونساز را جهت پیوند، ایجاد می کند. [ ۴] این دارو جهت استفاده در بیماران لنفوم و مولتیپل میلوما تأیید شده است. [ ۵]
مطالعات جانوری نشان داده است که این دارو تراتوژن است و به همین سبب مصرف آن در دوران بارداری ممنوع است؛ مگر در برخی بیمارانی که در شرایط بحرانی قرار دارند. تمام خانم هایی که در سنین باروری قرار دارند، باید پیش از مصرف پلریکسافور از یکی از روش های پیشگیری از بارداری استفاده کنند. معلوم نیست که این دارو به درون شیر مادر ترشح می شود یا خیر. شیردهی در حین مصرف این دارو می بایست متوقف شود. [ ۵]
تهوع، اسهال و واکنش های موضعی در ۱۰٪ از دریافت کنندگان مشاهده می شود. مشکلات هاضمه، گیجی، سردرد و دردهای عضلانی هم نسبتاً شایع است. احتمال بروز حساسیت کمتر از ۱٪ است. بیشتر عوارض جانبی در کارآزمایی های بالینی خفیف و گذرا بوده اند. [ ۵] [ ۶]
یک عارضهٔ خطرناک این دارو، احتمال تحرک سلول های سرطانی و جابجایی آنها به نقاط دیگر است که در بیماران مبتلا به سرطان خون مشاهده شده است. [ ۲]
یک عارضهٔ بالقوه دیگر پلریکسافور، احتمال پارگی خودبخودی طحال است. نگرانی ها از این عارضه، از آنجا ناشی می شود که اولاً در مدل های حیوانی این دارو سبب بزرگ طحالی می شود و ثانیاً فاکتور محرک کلونی گرانولوسیت در موارد نادر می تواند منجر به پارگی طحال شود.


wiki: پلریکسافور
