وستیت ( Wustite ) یک ماده معدنی ایجاد شده از آهن ( II ) اکسید است که در شهاب سنگ ها یافت شده. رنگ خاکستری مایل به سبز در نور بازتاب شده دارد. وستیت در مقیاس سختی موهس بین 5 تا 5. 5 قرار می گیرد و چگالی نسبی آن 5. 88 است. وستیت یک نمونه معمولی از ترکیب غیر استوکیومتری می باشد.
وستیت به خاطر فریتز ووست ( Fritz Wust ) ، یک متالوژریست آلمانی و مدیر عامل Kaiser - Wilhelm - Institut für Eisenforschung نام گذاری شد.
وستیت در طبیعت وجود ندارد و به عنوان کانی آهن معرفی نمی شود اما چون در مراحل نهایی احیای آهن تشکیل می شود لذا شناخت خصوصیات آن برای درک درست فرایند احیا لازم است. اگر چه اغلب فرمول شیمیایی این اکسید را به صورت FeO می نویسند ولی در واقع مقدار اکسیژن وستیت همیشه بیش از مقدار استوکیومتری است در نتیجه فرمول شیمیایی آن را می توان به صورت Fe 1 - xO نوشت، شبکه کریستالی وستیت مکعبی ( شبکه آن مانند شبکه کلرید سدیم است ) می باشد که در آن شبکه آهن ناقص بوده و جاهای خالی در شبکه وجود دارد. جهت خنثی شدن شبکه لازم است به ازای هر جای خالی آهن دو ظرفیتی، دو یون آهن سه ظرفیتی در شبکه وجود داشته باشد. مقدار X در فرمول شیمیایی وستیت بر حسب شرایط ( مثلاً درجه حرارت ) بین 0. 175 تا 0. 05 درصد تغییر می کند. با افزایش درجه حرارت تعداد جاهای خالی در شبکه وستیت افزایش می یابد. بنابراین درصد اکسیژن و تعداد یون های سه ظرفیتی نیز افزایش می یابد. در دمای 1524 درجه سانتی گراد در نقطه C نمودار پایداری اکسیدهای آهن، آهن مذاب اشباع از اکسیژن در تعادل با یک فاز مایع نامحلول اکسید آهن دو ظرفیتی است که حاوی 22. 6 درصد اکسیژن است. دمای ذوب این اکسید با افزایش اکسیژن کاهش می یابد و در دمای 1371 درجه سانتیگراد که کمترین مقدار دمای ذوب را دارد، در تعادل با آهن آستنیت جامد اشباع از اکسیژن است. بعد از آن دمای ذوب اکسید آهن دو ظرفیتی با زیاد شدن مقدار اکسیژن افزایش می یابد. از نمودار تعادلی دما - اکسیژن مشخص می شود اکسید آهن دو ظرفیتی که حاوی 22. 6 درصد اکسیژن است و به صورت FeO نشان داده می شود وجود خارجی ندارد. مقدار متوسط اکسیژن در محدوده دمایی 1371 - 600 درجه سانتی گراد برای وستیت اشباع از آهن، برابر 23. 2 درصد است بنابراین، فرمول شیمیایی وستیت در این محدوده دمایی FeO 0. 95 یا FeO 1. 05 است. تنها برای راحتی محاسبات فرمول شیمیایی وستیت را به صورت FeO می نویسند.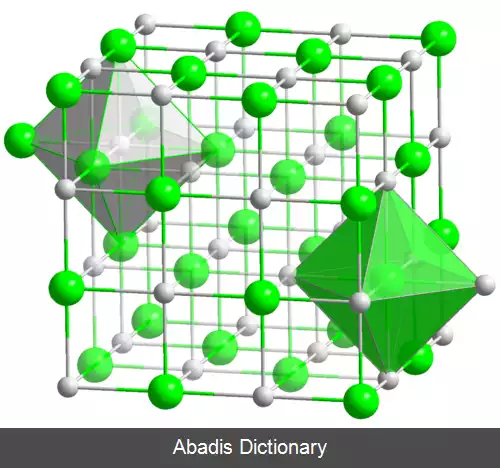
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفوستیت به خاطر فریتز ووست ( Fritz Wust ) ، یک متالوژریست آلمانی و مدیر عامل Kaiser - Wilhelm - Institut für Eisenforschung نام گذاری شد.
وستیت در طبیعت وجود ندارد و به عنوان کانی آهن معرفی نمی شود اما چون در مراحل نهایی احیای آهن تشکیل می شود لذا شناخت خصوصیات آن برای درک درست فرایند احیا لازم است. اگر چه اغلب فرمول شیمیایی این اکسید را به صورت FeO می نویسند ولی در واقع مقدار اکسیژن وستیت همیشه بیش از مقدار استوکیومتری است در نتیجه فرمول شیمیایی آن را می توان به صورت Fe 1 - xO نوشت، شبکه کریستالی وستیت مکعبی ( شبکه آن مانند شبکه کلرید سدیم است ) می باشد که در آن شبکه آهن ناقص بوده و جاهای خالی در شبکه وجود دارد. جهت خنثی شدن شبکه لازم است به ازای هر جای خالی آهن دو ظرفیتی، دو یون آهن سه ظرفیتی در شبکه وجود داشته باشد. مقدار X در فرمول شیمیایی وستیت بر حسب شرایط ( مثلاً درجه حرارت ) بین 0. 175 تا 0. 05 درصد تغییر می کند. با افزایش درجه حرارت تعداد جاهای خالی در شبکه وستیت افزایش می یابد. بنابراین درصد اکسیژن و تعداد یون های سه ظرفیتی نیز افزایش می یابد. در دمای 1524 درجه سانتی گراد در نقطه C نمودار پایداری اکسیدهای آهن، آهن مذاب اشباع از اکسیژن در تعادل با یک فاز مایع نامحلول اکسید آهن دو ظرفیتی است که حاوی 22. 6 درصد اکسیژن است. دمای ذوب این اکسید با افزایش اکسیژن کاهش می یابد و در دمای 1371 درجه سانتیگراد که کمترین مقدار دمای ذوب را دارد، در تعادل با آهن آستنیت جامد اشباع از اکسیژن است. بعد از آن دمای ذوب اکسید آهن دو ظرفیتی با زیاد شدن مقدار اکسیژن افزایش می یابد. از نمودار تعادلی دما - اکسیژن مشخص می شود اکسید آهن دو ظرفیتی که حاوی 22. 6 درصد اکسیژن است و به صورت FeO نشان داده می شود وجود خارجی ندارد. مقدار متوسط اکسیژن در محدوده دمایی 1371 - 600 درجه سانتی گراد برای وستیت اشباع از آهن، برابر 23. 2 درصد است بنابراین، فرمول شیمیایی وستیت در این محدوده دمایی FeO 0. 95 یا FeO 1. 05 است. تنها برای راحتی محاسبات فرمول شیمیایی وستیت را به صورت FeO می نویسند.

wiki: وستیت
