واکنش شیمیایی ( به انگلیسی: Chemical reaction ) فرایندی است که در آن ساختار ذره های تشکیل دهندهٔ مواد اولیه دچار تغییر می شود؛ یعنی طی آن یک یا چند ماده شیمیایی به یک یا چند ماده شیمیایی دیگر تبدیل می شود؛ مثلاً:
پدیده شیمی هم قابل برگشت است هم غیر قابل برگشت
تغییراتی که در واکنشی بر روی مواد واکنش دهنده صورت می گیرد، به طور کلی به دو نوع تغییرات فیزیکی و شیمیایی تقسیم می شوند.
ذره های تشکیل دهنده ماده؛ بنابراین تغییرات همهٔ حالات ماده مانند ذوب، انجماد، تبخیر، میعان، تصعید ( فرازش ) و چگالش و همچنین انحلال نمک ها و بازها در آب، تغییر فیزیکی هستند.
در تغییرات شیمیایی اتصال اتم ها به یکدیگر و آرایش الکترونی آن ها در واکنش دهنده ها تغییر می یابد. البته در یک واکنش شیمیایی، اتم ها نه به وجود می آیند و نه از بین می روند و تنها ترکیب، تجزیه یا بازآرایی می شوند. واکنش شیمیایی بیان یک تغییر شیمیایی است که ممکن است با آزاد کردن انرژی به صورت گرما، نور یا صوت همراه باشند و تولید گاز، تشکیل رسوب یا تغییر رنگ در پی داشته باشند.
مواردی وجود دارد که هر دو تغییر فیزیکی و شیمیایی بر روی یک پدیده، به طور متوالی اتفاق می افتند. برای نمونه، با حرارت دادن تکه ای قند در لوله آزمایش، ابتدا قند ذوب می شود که یک پدیدهٔ فیزیکی است. سپس به رنگ قهوه ای در می آید که نشان دهندهٔ شروع تبدیل قند به کربن و یک پدیدهٔ شیمیایی است. در ادامه مقداری بخار آب به بالای لوله می رسد که نشانهٔ تجزیهٔ قند و ادامهٔ پدیدهٔ شیمیایی پیشین است. سپس قطره های آب روی دیوارهٔ لولهٔ آزمایش پدیدار می شود که نشان دهندهٔ میعان بخار آب آزاد شده و یک پدیدهٔ فیزیکی است. در پایان، در لوله ماده ای سیاه رنگ، بی مزه و نامحلول در آب ( برخلاف قند اولیه ) باقی می ماند که این ماده زغال است و با توجه به تغییر رنگ، مزه و قابلیت حلالیت آن در آب می توان آن را تشخیص داد.
هر نوع پیوندی میان اتم های مختلف سازندهٔ مولکول های یک جسم، نوعی انرژی در انرژی شیمیایی دارد که مقدار آن به نوع اتم ها و نحوهٔ قرار گرفتن آن ها در مولکول بستگی دارد. در یک واکنش شیمیایی، در واقع اتصال اتم ها به یکدیگر در واکنش ها تغییر می کند و در نتیجه انرژی شیمیایی فراورده های واکنش با انرژی شیمیایی واکنش دهنده ها تفاوت پیدا می کند.
به عنوان مثال، واکنش گاز کلر با گاز هیدروژن را در نظر بگیریم. گاز کلر از مولکول های دو اتمی Cl۲ و گاز هیدروژن از مولکول های دو اتمی H۲ تشکیل شده اند. فراوردهٔ واکنش، کلرید هیدروژن HCl خواهد بود که در مقایسه با واکنش دهنده، پیوندهای کاملاً متفاوتی دارد و از این رو انرژی شیمیایی آن ها متفاوت است.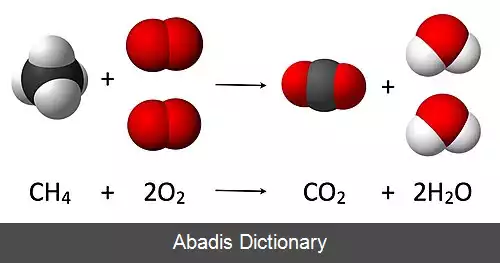
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفپدیده شیمی هم قابل برگشت است هم غیر قابل برگشت
تغییراتی که در واکنشی بر روی مواد واکنش دهنده صورت می گیرد، به طور کلی به دو نوع تغییرات فیزیکی و شیمیایی تقسیم می شوند.
ذره های تشکیل دهنده ماده؛ بنابراین تغییرات همهٔ حالات ماده مانند ذوب، انجماد، تبخیر، میعان، تصعید ( فرازش ) و چگالش و همچنین انحلال نمک ها و بازها در آب، تغییر فیزیکی هستند.
در تغییرات شیمیایی اتصال اتم ها به یکدیگر و آرایش الکترونی آن ها در واکنش دهنده ها تغییر می یابد. البته در یک واکنش شیمیایی، اتم ها نه به وجود می آیند و نه از بین می روند و تنها ترکیب، تجزیه یا بازآرایی می شوند. واکنش شیمیایی بیان یک تغییر شیمیایی است که ممکن است با آزاد کردن انرژی به صورت گرما، نور یا صوت همراه باشند و تولید گاز، تشکیل رسوب یا تغییر رنگ در پی داشته باشند.
مواردی وجود دارد که هر دو تغییر فیزیکی و شیمیایی بر روی یک پدیده، به طور متوالی اتفاق می افتند. برای نمونه، با حرارت دادن تکه ای قند در لوله آزمایش، ابتدا قند ذوب می شود که یک پدیدهٔ فیزیکی است. سپس به رنگ قهوه ای در می آید که نشان دهندهٔ شروع تبدیل قند به کربن و یک پدیدهٔ شیمیایی است. در ادامه مقداری بخار آب به بالای لوله می رسد که نشانهٔ تجزیهٔ قند و ادامهٔ پدیدهٔ شیمیایی پیشین است. سپس قطره های آب روی دیوارهٔ لولهٔ آزمایش پدیدار می شود که نشان دهندهٔ میعان بخار آب آزاد شده و یک پدیدهٔ فیزیکی است. در پایان، در لوله ماده ای سیاه رنگ، بی مزه و نامحلول در آب ( برخلاف قند اولیه ) باقی می ماند که این ماده زغال است و با توجه به تغییر رنگ، مزه و قابلیت حلالیت آن در آب می توان آن را تشخیص داد.
هر نوع پیوندی میان اتم های مختلف سازندهٔ مولکول های یک جسم، نوعی انرژی در انرژی شیمیایی دارد که مقدار آن به نوع اتم ها و نحوهٔ قرار گرفتن آن ها در مولکول بستگی دارد. در یک واکنش شیمیایی، در واقع اتصال اتم ها به یکدیگر در واکنش ها تغییر می کند و در نتیجه انرژی شیمیایی فراورده های واکنش با انرژی شیمیایی واکنش دهنده ها تفاوت پیدا می کند.
به عنوان مثال، واکنش گاز کلر با گاز هیدروژن را در نظر بگیریم. گاز کلر از مولکول های دو اتمی Cl۲ و گاز هیدروژن از مولکول های دو اتمی H۲ تشکیل شده اند. فراوردهٔ واکنش، کلرید هیدروژن HCl خواهد بود که در مقایسه با واکنش دهنده، پیوندهای کاملاً متفاوتی دارد و از این رو انرژی شیمیایی آن ها متفاوت است.

wiki: واکنش شیمیایی
