هیبریداسیون اوربیتال ( به انگلیسی: Orbital hybridisation ) فرآیندی ست در شیمی کوانتومی که طی آن اوربیتال های اتم ها با یکدیگر ترکیب شده و اوربیتال های مولکولی یا پیوندی را با شکل، انرژی و مشخصات متفاوت ایجاد می کنند که مسئولیت ایجاد پیوند شیمیایی را بر عهده دارند. [ ۱]
شیمیدان لینوس پاولینگ برای اولین بار در سال 1931 نظریه هیبریداسیون را برای توضیح ساختار مولکول های ساده مانند متان ( CH4 ) با استفاده از اوربیتال های اتمی توسعه داد. پاولینگ اشاره کرد که یک اتم کربن با استفاده از یک s و سه اوربیتال p چهار پیوند تشکیل می دهد، بنابراین "ممکن است استنباط شود" که یک اتم کربن سه پیوند در زاویه قائمه ( با استفاده از اوربیتال های p ) و چهارمین پیوند ضعیف تر با استفاده از اوربیتال مداری s در برخی جهت دلخواه تشکیل می دهد. در واقع، متان دارای چهار پیوند C - H با قدرت معادل است. پاولینگ فرض می کرد که در حضور چهار اتم هیدروژن، اوربیتال های s و p چهار ترکیب معادل را تشکیل می دهند که او اوربیتال های ترکیبی نامید. هر هیبرید برای نشان دادن ترکیب آن با sp3 نشان داده می شود و در امتداد یکی از چهار پیوند C - H هدایت می شود. این مفهوم برای چنین سیستم های شیمیایی ساده توسعه داده شد، اما این رویکرد بعداً به طور گسترده تری به کار رفت و امروزه به عنوان یک اکتشافی مؤثر برای منطقی کردن ساختارهای ترکیبات آلی در نظر گرفته می شود. این تصویر مداری ساده ای معادل ساختارهای لوئیس می دهد.
برای مثال ساختار الکترونی اتم کربن به صورت زیر است:
حال انواع هیبرید اتم کربن به صورت زیر خواهد بود:
هیبریداسیون sp، دارای ساختار خطی با زاویه 180درجه در مولکول آن است که در این مدل، اوربیتال 2s و یکی از اوربیتال های 2p، برای تشکیل دو اوربیتال sp هیبرید می شوند که هرکدام، دارای 50 درصد خاصیت s و ۵۰ درصد خاصیت p هستند.
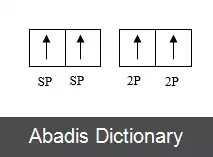
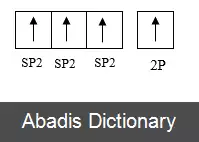
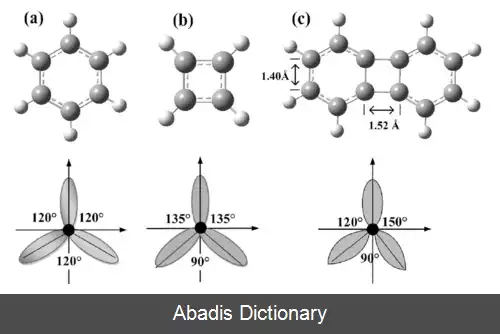
برای هر اتم کربن، یک اوربیتال 2s و دو اوربیتال 2p هیبرید می شوند و سه اوربیتال sp2 و یک اوربیتال 2p ایجاد میشود. برای مولکول کربن sp2 هیبرید می شود، زیرا یک پیوند ( pi ) برای پیوند دوگانه بین کربن ها لازم است و تنها سه پیوند سیگما ( σ ) در هر اتم کربن تشکیل می شود. در هیبریداسیون sp2 اوربیتال 2s تنها با دو اوربیتال از سه اوربیتال 2p موجود مخلوط می شود که معمولاً 2px و 2py نشان داده می شوند. سومین اوربیتال 2p ( 2pz ) بدون هیبرید باقی می ماند. ساختار هر مولکول کربن، به صورت سه ضلعی مسطح خواهد بود.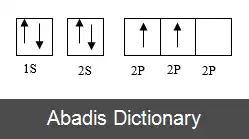
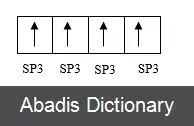
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفشیمیدان لینوس پاولینگ برای اولین بار در سال 1931 نظریه هیبریداسیون را برای توضیح ساختار مولکول های ساده مانند متان ( CH4 ) با استفاده از اوربیتال های اتمی توسعه داد. پاولینگ اشاره کرد که یک اتم کربن با استفاده از یک s و سه اوربیتال p چهار پیوند تشکیل می دهد، بنابراین "ممکن است استنباط شود" که یک اتم کربن سه پیوند در زاویه قائمه ( با استفاده از اوربیتال های p ) و چهارمین پیوند ضعیف تر با استفاده از اوربیتال مداری s در برخی جهت دلخواه تشکیل می دهد. در واقع، متان دارای چهار پیوند C - H با قدرت معادل است. پاولینگ فرض می کرد که در حضور چهار اتم هیدروژن، اوربیتال های s و p چهار ترکیب معادل را تشکیل می دهند که او اوربیتال های ترکیبی نامید. هر هیبرید برای نشان دادن ترکیب آن با sp3 نشان داده می شود و در امتداد یکی از چهار پیوند C - H هدایت می شود. این مفهوم برای چنین سیستم های شیمیایی ساده توسعه داده شد، اما این رویکرد بعداً به طور گسترده تری به کار رفت و امروزه به عنوان یک اکتشافی مؤثر برای منطقی کردن ساختارهای ترکیبات آلی در نظر گرفته می شود. این تصویر مداری ساده ای معادل ساختارهای لوئیس می دهد.
برای مثال ساختار الکترونی اتم کربن به صورت زیر است:
حال انواع هیبرید اتم کربن به صورت زیر خواهد بود:
هیبریداسیون sp، دارای ساختار خطی با زاویه 180درجه در مولکول آن است که در این مدل، اوربیتال 2s و یکی از اوربیتال های 2p، برای تشکیل دو اوربیتال sp هیبرید می شوند که هرکدام، دارای 50 درصد خاصیت s و ۵۰ درصد خاصیت p هستند.
برای هر اتم کربن، یک اوربیتال 2s و دو اوربیتال 2p هیبرید می شوند و سه اوربیتال sp2 و یک اوربیتال 2p ایجاد میشود. برای مولکول کربن sp2 هیبرید می شود، زیرا یک پیوند ( pi ) برای پیوند دوگانه بین کربن ها لازم است و تنها سه پیوند سیگما ( σ ) در هر اتم کربن تشکیل می شود. در هیبریداسیون sp2 اوربیتال 2s تنها با دو اوربیتال از سه اوربیتال 2p موجود مخلوط می شود که معمولاً 2px و 2py نشان داده می شوند. سومین اوربیتال 2p ( 2pz ) بدون هیبرید باقی می ماند. ساختار هر مولکول کربن، به صورت سه ضلعی مسطح خواهد بود.






wiki: هیبریداسیون اوربیتال
