هندسه مولکولی ( به انگلیسی: Molecular geometry ) در علم شیمی و زیست شیمی عبارت است از بررسی چگونگی قرارگیری اتم ها در فضای سه بعدی در یک مولکول شیمیایی. این موضوع تعیین کننده خواصی چون فاز ماده، قطبیت شیمیایی، رنگ، خاصیت مغناطیسی و واکنش پذیری در یک ماده است. [ ۱] [ ۲]
هندسه مولکولی را می توان با روش های مختلف طیف سنجی و روش های پراش تعیین کرد. طیف سنجی IR، مایکروویو و رامان می توانند اطلاعاتی در مورد هندسه مولکول از جزئیات جذب ارتعاشی و چرخشی شناسایی شده توسط این تکنیک ها به دست دهند. کریستالوگرافی اشعه ایکس، پراش نوترون و پراش الکترون می توانند ساختار مولکولی را برای جامدات کریستالی بر اساس فاصله بین هسته ها و غلظت چگالی الکترون ارائه دهند. پراش الکترون گاز را می توان برای مولکول های کوچک در فاز گاز استفاده کرد. روش های NMR و FRET می توانند برای تعیین اطلاعات تکمیلی از جمله فواصل نسبی، زوایای دو وجهی، زاویه و اتصال استفاده شوند. هندسه های مولکولی به بهترین وجه در دمای پایین تعیین می شوند زیرا در دماهای بالاتر ساختار مولکولی در هندسه های قابل دسترس تر به طور میانگین محاسبه می شود ( به بخش بعدی مراجعه کنید ) . مولکول های بزرگ تر اغلب در چندین هندسه پایدار ( ایزومر ساختاری ) وجود دارند که از نظر انرژی در سطح انرژی پتانسیل نزدیک هستند. هندسه ها را نیز می توان با روش های شیمی کوانتومی از ابتدا با دقت بالا محاسبه کرد. هندسه مولکولی می تواند به صورت جامد، محلول و گاز متفاوت باشد. موقعیت هر اتم با ماهیت پیوندهای شیمیایی که توسط آن به اتم های همسایه خود متصل می شود تعیین می شود. هندسه مولکولی را می توان با موقعیت این اتم ها در فضا توصیف کرد، که طول پیوند دو اتم به هم پیوسته، زاویه پیوند سه اتم متصل، و زاویه پیچش ( زوایای دو وجهی ) سه پیوند متوالی را برمی انگیزد.
از آنجایی که حرکت اتم ها در یک مولکول توسط مکانیک کوانتومی تعیین می شود، "حرکت" باید به روش مکانیکی کوانتومی تعریف شود. انتقال و چرخش کلی ( خارجی ) حرکت مکانیکی کوانتومی هندسه مولکول را به سختی تغییر می دهد. ( تا حدی چرخش از طریق نیروهای کوریولیس و اعوجاج گریز از مرکز هندسه را تحت تأثیر قرار می دهد، اما این برای بحث حاضر قابل اغماض است. ) علاوه بر انتقال و چرخش، نوع سوم حرکت، ارتعاش مولکولی است که با حرکات داخلی اتم ها مطابقت دارد. به عنوان کشش باند و تغییر زاویه پیوند. ارتعاشات مولکولی هارمونیک هستند ( حداقل با تقریب خوب ) ، و اتم ها در مورد موقعیت های تعادلی خود نوسان می کنند، حتی در صفر مطلق دما. در صفر مطلق همه اتم ها در حالت پایه ارتعاشی خود هستند و حرکت مکانیکی کوانتومی نقطه صفر را نشان می دهند، به طوری که تابع موج یک حالت ارتعاشی منفرد یک اوج تیز نیست، بلکه یک نمایی با عرض محدود است ( تابع موج برای n = 0 نشان داده شده در مقاله در مورد نوسانگر هارمونیک کوانتومی ) . در دماهای بالاتر، حالت های ارتعاشی ممکن است از نظر حرارتی برانگیخته شوند ( در یک تفسیر کلاسیک، یکی این را با بیان اینکه "مولکول ها سریع تر می لرزند" بیان می کند ) ، اما آنها همچنان در اطراف هندسه قابل تشخیص مولکول در نوسان هستند.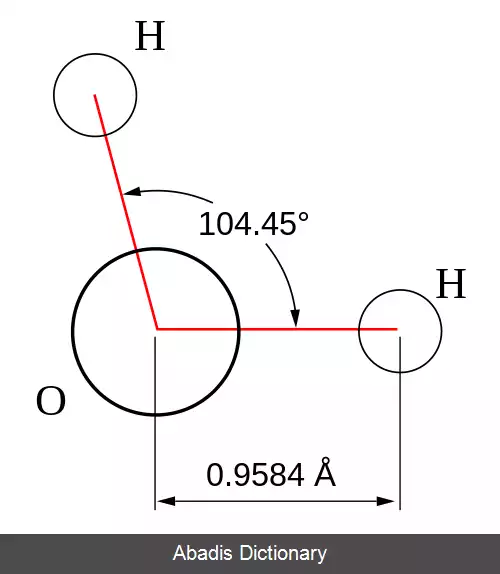
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفهندسه مولکولی را می توان با روش های مختلف طیف سنجی و روش های پراش تعیین کرد. طیف سنجی IR، مایکروویو و رامان می توانند اطلاعاتی در مورد هندسه مولکول از جزئیات جذب ارتعاشی و چرخشی شناسایی شده توسط این تکنیک ها به دست دهند. کریستالوگرافی اشعه ایکس، پراش نوترون و پراش الکترون می توانند ساختار مولکولی را برای جامدات کریستالی بر اساس فاصله بین هسته ها و غلظت چگالی الکترون ارائه دهند. پراش الکترون گاز را می توان برای مولکول های کوچک در فاز گاز استفاده کرد. روش های NMR و FRET می توانند برای تعیین اطلاعات تکمیلی از جمله فواصل نسبی، زوایای دو وجهی، زاویه و اتصال استفاده شوند. هندسه های مولکولی به بهترین وجه در دمای پایین تعیین می شوند زیرا در دماهای بالاتر ساختار مولکولی در هندسه های قابل دسترس تر به طور میانگین محاسبه می شود ( به بخش بعدی مراجعه کنید ) . مولکول های بزرگ تر اغلب در چندین هندسه پایدار ( ایزومر ساختاری ) وجود دارند که از نظر انرژی در سطح انرژی پتانسیل نزدیک هستند. هندسه ها را نیز می توان با روش های شیمی کوانتومی از ابتدا با دقت بالا محاسبه کرد. هندسه مولکولی می تواند به صورت جامد، محلول و گاز متفاوت باشد. موقعیت هر اتم با ماهیت پیوندهای شیمیایی که توسط آن به اتم های همسایه خود متصل می شود تعیین می شود. هندسه مولکولی را می توان با موقعیت این اتم ها در فضا توصیف کرد، که طول پیوند دو اتم به هم پیوسته، زاویه پیوند سه اتم متصل، و زاویه پیچش ( زوایای دو وجهی ) سه پیوند متوالی را برمی انگیزد.
از آنجایی که حرکت اتم ها در یک مولکول توسط مکانیک کوانتومی تعیین می شود، "حرکت" باید به روش مکانیکی کوانتومی تعریف شود. انتقال و چرخش کلی ( خارجی ) حرکت مکانیکی کوانتومی هندسه مولکول را به سختی تغییر می دهد. ( تا حدی چرخش از طریق نیروهای کوریولیس و اعوجاج گریز از مرکز هندسه را تحت تأثیر قرار می دهد، اما این برای بحث حاضر قابل اغماض است. ) علاوه بر انتقال و چرخش، نوع سوم حرکت، ارتعاش مولکولی است که با حرکات داخلی اتم ها مطابقت دارد. به عنوان کشش باند و تغییر زاویه پیوند. ارتعاشات مولکولی هارمونیک هستند ( حداقل با تقریب خوب ) ، و اتم ها در مورد موقعیت های تعادلی خود نوسان می کنند، حتی در صفر مطلق دما. در صفر مطلق همه اتم ها در حالت پایه ارتعاشی خود هستند و حرکت مکانیکی کوانتومی نقطه صفر را نشان می دهند، به طوری که تابع موج یک حالت ارتعاشی منفرد یک اوج تیز نیست، بلکه یک نمایی با عرض محدود است ( تابع موج برای n = 0 نشان داده شده در مقاله در مورد نوسانگر هارمونیک کوانتومی ) . در دماهای بالاتر، حالت های ارتعاشی ممکن است از نظر حرارتی برانگیخته شوند ( در یک تفسیر کلاسیک، یکی این را با بیان اینکه "مولکول ها سریع تر می لرزند" بیان می کند ) ، اما آنها همچنان در اطراف هندسه قابل تشخیص مولکول در نوسان هستند.

wiki: هندسه مولکولی
