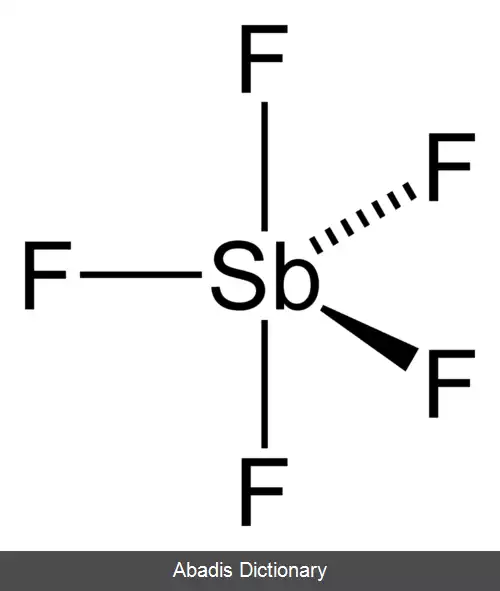
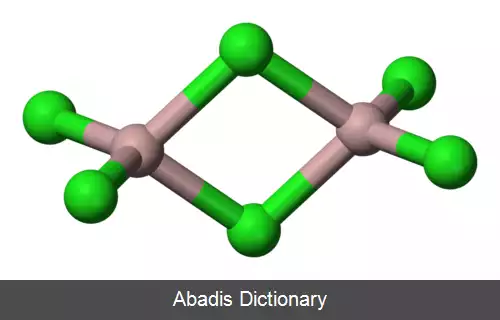
هالیدهای فلزی ترکیباتی هستند که بین فلزات و هالوژن ها به وجود می آیند. برخی از اینها، مانند سدیم کلرید، یونی هستند در حالی که برخی دیگر از طریق پیوند کووالانسی متصل می شوند. تعداد کمی از هالیدهای فلزی به صورت مولکول های جداگانه وجود دارند، مانند هگزافلوراید اورانیوم، اما اکثر آن ها ساختارهای پلیمریک را اتخاذ می کنند، مانند کلرید پالادیوم. [ ۱] [ ۲]
هالوژن ها همگی می توانند با فلزات واکنش دهند و با توجه به معادله زیر هالیدهای فلزی بسازند:
که در آن M فلز، X هالوژن، و MXn هالید فلزی هستند.
در عمل، این نوع واکنش ممکن است بسیار اکسوترمی باشد، بنابراین به عنوان یک تکنیک آماده سازی عملی غیرقابل استفاده باشد. علاوه بر این، بسیاری از فلزات واسطه قادرند استاته های اکسایشی متعددی بپذیرند که موضوعات را پیچیده تر می کند. از آنجا که هالوژن ها اکساینده های قوی هستند، ترکیب مستقیم عناصر معمولاً به تشکیل هالید فلزی با اکسایش بالا منجر می شود. به عنوان مثال، کلرید فریک تا این شکل تهیه می شود، اما کلرید فریس به راحتی تهیه نمی شود. گرم کردن هالیدهای بالاتر ممکن است به تشکیل هالیدهای پایین تر منجر شود؛ این اتفاق به وسیله تجزیه حرارتی یا ناسپرده اتفاق می افتد. به عنوان مثال، کلرید طلا ( III ) به کلرید طلا ( I ) منتقل می شود:[ ۱]
هالیدهای فلزی نیز با نترالیزه اکسید فلز، هیدروکسید یا کربنات با هالوآسید مناسب تهیه می شوند. به عنوان مثال با هیدروکسید سدیم:[ ۱]
گاهی اوقات می توان آب را با گرما، خلوص، یا حضور اسیدهالوژنید بی آب کرد. هالیدهای فلزی بدون آب که برای تهیه ترکیبات هماهنگی دیگر مناسب هستند می توانند با استفاده از ترکیب با تیونیل کلرید خشک شوند:[ ۱] [ ۳]
یون های نقره و تالیوم ( I ) علاقه بسیاری به یون های هالید در محلول دارند و هالید فلزی به صورت کمی از محلول آبی ایجاد می شود. این واکنش به حدی قابل اعتماد است که نیترات نقره برای آزمایش حضور و مقدار یون های هالید استفاده می شود. واکنش یون های نقره با یون های برمید:
برخی از هالیدهای فلزی ممکن است با واکنش اکسیدها با هالوژن ها در حضور کربن کاهش کربوترمال تهیه شوند:
هالیدهای فلزی «یونی» ( به ویژه هالیدهای فلزات قلیایی و قلیایی خاکی ) معمولاً دارای نقاط ذوب و جوش بسیار بالایی هستند. آن ها به راحتی در آب حل می شوند و برخی از آن ها خاصیت جذب رطوبت دارند. معمولاً در حلال های آلی کم محلول هستند.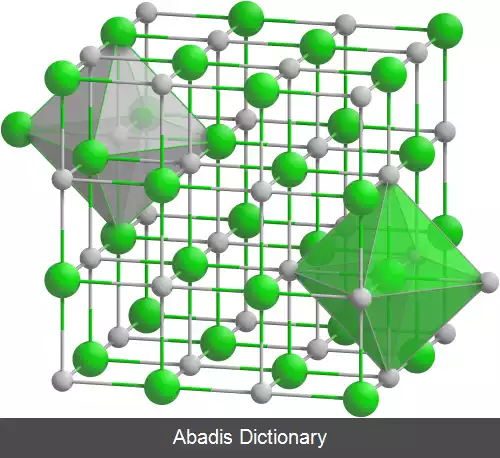

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفهالوژن ها همگی می توانند با فلزات واکنش دهند و با توجه به معادله زیر هالیدهای فلزی بسازند:
که در آن M فلز، X هالوژن، و MXn هالید فلزی هستند.
در عمل، این نوع واکنش ممکن است بسیار اکسوترمی باشد، بنابراین به عنوان یک تکنیک آماده سازی عملی غیرقابل استفاده باشد. علاوه بر این، بسیاری از فلزات واسطه قادرند استاته های اکسایشی متعددی بپذیرند که موضوعات را پیچیده تر می کند. از آنجا که هالوژن ها اکساینده های قوی هستند، ترکیب مستقیم عناصر معمولاً به تشکیل هالید فلزی با اکسایش بالا منجر می شود. به عنوان مثال، کلرید فریک تا این شکل تهیه می شود، اما کلرید فریس به راحتی تهیه نمی شود. گرم کردن هالیدهای بالاتر ممکن است به تشکیل هالیدهای پایین تر منجر شود؛ این اتفاق به وسیله تجزیه حرارتی یا ناسپرده اتفاق می افتد. به عنوان مثال، کلرید طلا ( III ) به کلرید طلا ( I ) منتقل می شود:[ ۱]
هالیدهای فلزی نیز با نترالیزه اکسید فلز، هیدروکسید یا کربنات با هالوآسید مناسب تهیه می شوند. به عنوان مثال با هیدروکسید سدیم:[ ۱]
گاهی اوقات می توان آب را با گرما، خلوص، یا حضور اسیدهالوژنید بی آب کرد. هالیدهای فلزی بدون آب که برای تهیه ترکیبات هماهنگی دیگر مناسب هستند می توانند با استفاده از ترکیب با تیونیل کلرید خشک شوند:[ ۱] [ ۳]
یون های نقره و تالیوم ( I ) علاقه بسیاری به یون های هالید در محلول دارند و هالید فلزی به صورت کمی از محلول آبی ایجاد می شود. این واکنش به حدی قابل اعتماد است که نیترات نقره برای آزمایش حضور و مقدار یون های هالید استفاده می شود. واکنش یون های نقره با یون های برمید:
برخی از هالیدهای فلزی ممکن است با واکنش اکسیدها با هالوژن ها در حضور کربن کاهش کربوترمال تهیه شوند:
هالیدهای فلزی «یونی» ( به ویژه هالیدهای فلزات قلیایی و قلیایی خاکی ) معمولاً دارای نقاط ذوب و جوش بسیار بالایی هستند. آن ها به راحتی در آب حل می شوند و برخی از آن ها خاصیت جذب رطوبت دارند. معمولاً در حلال های آلی کم محلول هستند.




wiki: هالیدهای فلزی
