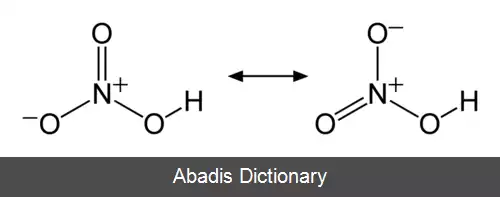
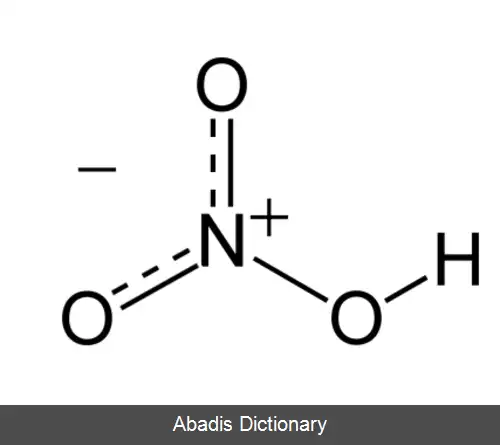
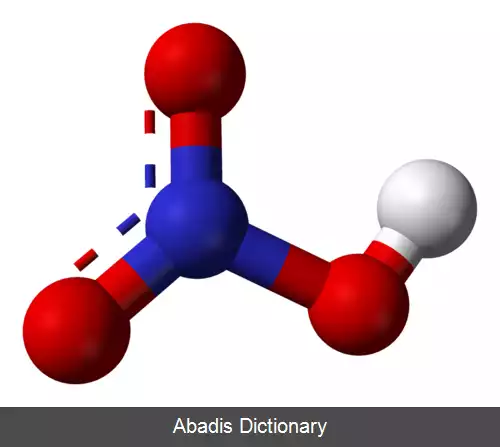
اسید نیتریک یا جوهر شوره با فرمول HNO3 نوعی اسید معدنی بسیار قوی است. ترکیب خالص آن بی رنگ است، اما با گذشت زمان به دلیل تجزیه به اکسیدهای نیتروژن و آب، به مرور زردرنگ می شود. [ ۲]
اسید نیتریک خالص ( HNO3 ) در ۴۱٫۶ - درجه سلسیوس ذوب شده، تولید مایع بی رنگی می کند، اما نسبت به درجه حرارت و درجه تابش نور بر آن، گستره رنگ آن از زرد تا قرمز متمایل به قهوه ای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
4HNO3 → 2H2O + 4NO2 + O2
به این علت ظرف های محتوی آن، همیشه تحت فشار کنترل شده می باشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل می دهد که نقطه جوش آن برابر با ۱۲۱٫۹ درجه سلسیوس است که شامل ۶۸٫۷٪ وزنی HNO3 می باشد.
اکثر اسید نیتریک های موجود در بازار غلظتی برابر ۶۸٪ درون آب دارند. این محلول با نقطه جوش ۱۲۰٫۵ درجه سلسیوس در فشار یک اتمسفر می باشد. دو شکل هیدراته برای آن شناخته شده است:
• مونو هیدرات ( HNO3·H2O )
• تری هیدرات ( HNO3·3H2O )
اگر غلظت اسید نیتریک بیشتر از ۸۶٪ شود به آن اسید نیتریک دودزا ( به انگلیسی: fuming nitric acid ) می گویند. [ ۲] به اسید نیتریک با غلظت بیش از ۹۵٪ اسید نیتریک دودسفید و به اسید نتیریک با غلظت بیش از ۸۶٪ اسید نیتریک دودقرمز گفته می شود. از این اسیدها به عنوان اکساینده در سوخت راکت استفاده می شود. [ ۳]
از اسید نیتریک در سده شانزدهم برای جداسازی طلا از نقره استفاده می شد.
اسید نیتریک را از شوره به دست می آورند؛ بدین طریق که سولفات آهن یا زاج را در حالت گرم روی شوره اثر می دادند. این طریقه تولید نشان می دهد که شوره مصرفی، خالص بوده است. به ترکیبی از دو ماده، کمی ماسه، آهک یا سفال شکسته می افزودند؛ ماده به دست آمده را در یک شیشه کوچک در دار می ریختند. این شیشه ها را در کوره آهک پزی می گذاشتند که می توانست دو ردیف از این شیشه ها را که هر ردیف چهار تا شیشه بود دربرگیرد. این شیشه ها را تا گردن در خاک یا خاکستر، که سبب پخش گرما و جلوگیری از ترک برداری شیشه می شد، قرار می دادند. از در پوش شیشه ها لوله هایی خارج می شد که به همین تعداد شیشه های مایع کننده، بر روی سکویی خارج از کوره متصل بودند. همه اتصالات به دقت آب بندی می شدند. حرارت نخست معتدل بود تا ماده خام درون شیشه ها خشک شود، سپس هر شش ساعت به شش ساعت حرارت را زیاد می کردند، گازهای نیترو به وسیلهٔ آب تبلور نمکها، به خارج کشیده می شد. هر وقت رنگ محصول تقطیر نشان می داد که تجزیه به پایان رسیده است، حرارت را به تدریج کم می کردند.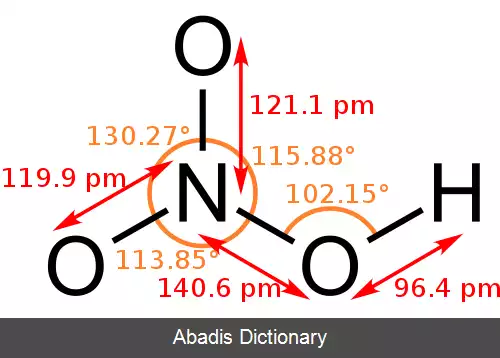
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاسید نیتریک خالص ( HNO3 ) در ۴۱٫۶ - درجه سلسیوس ذوب شده، تولید مایع بی رنگی می کند، اما نسبت به درجه حرارت و درجه تابش نور بر آن، گستره رنگ آن از زرد تا قرمز متمایل به قهوه ای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
4HNO3 → 2H2O + 4NO2 + O2
به این علت ظرف های محتوی آن، همیشه تحت فشار کنترل شده می باشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل می دهد که نقطه جوش آن برابر با ۱۲۱٫۹ درجه سلسیوس است که شامل ۶۸٫۷٪ وزنی HNO3 می باشد.
اکثر اسید نیتریک های موجود در بازار غلظتی برابر ۶۸٪ درون آب دارند. این محلول با نقطه جوش ۱۲۰٫۵ درجه سلسیوس در فشار یک اتمسفر می باشد. دو شکل هیدراته برای آن شناخته شده است:
• مونو هیدرات ( HNO3·H2O )
• تری هیدرات ( HNO3·3H2O )
اگر غلظت اسید نیتریک بیشتر از ۸۶٪ شود به آن اسید نیتریک دودزا ( به انگلیسی: fuming nitric acid ) می گویند. [ ۲] به اسید نیتریک با غلظت بیش از ۹۵٪ اسید نیتریک دودسفید و به اسید نتیریک با غلظت بیش از ۸۶٪ اسید نیتریک دودقرمز گفته می شود. از این اسیدها به عنوان اکساینده در سوخت راکت استفاده می شود. [ ۳]
از اسید نیتریک در سده شانزدهم برای جداسازی طلا از نقره استفاده می شد.
اسید نیتریک را از شوره به دست می آورند؛ بدین طریق که سولفات آهن یا زاج را در حالت گرم روی شوره اثر می دادند. این طریقه تولید نشان می دهد که شوره مصرفی، خالص بوده است. به ترکیبی از دو ماده، کمی ماسه، آهک یا سفال شکسته می افزودند؛ ماده به دست آمده را در یک شیشه کوچک در دار می ریختند. این شیشه ها را در کوره آهک پزی می گذاشتند که می توانست دو ردیف از این شیشه ها را که هر ردیف چهار تا شیشه بود دربرگیرد. این شیشه ها را تا گردن در خاک یا خاکستر، که سبب پخش گرما و جلوگیری از ترک برداری شیشه می شد، قرار می دادند. از در پوش شیشه ها لوله هایی خارج می شد که به همین تعداد شیشه های مایع کننده، بر روی سکویی خارج از کوره متصل بودند. همه اتصالات به دقت آب بندی می شدند. حرارت نخست معتدل بود تا ماده خام درون شیشه ها خشک شود، سپس هر شش ساعت به شش ساعت حرارت را زیاد می کردند، گازهای نیترو به وسیلهٔ آب تبلور نمکها، به خارج کشیده می شد. هر وقت رنگ محصول تقطیر نشان می داد که تجزیه به پایان رسیده است، حرارت را به تدریج کم می کردند.




wiki: نیتریک اسید




