نمودار الینگهام دارای دو مولفه دما و تغییرات انرژی آزاد گیبس، Δ G ، است که Δ G نشان دهنده میزان پایداری ترکیب می باشد.
این نمودار به رابطه بین این دو مولفه می پردازد. تحلیل هایی که بر اساس نمودار الینگهام انجام می شوند، معمولاً برای سنجش میزان دشواری فرایند کاهش اکسیدهای فلزی و سولفیدها استفاده می شوند. این نمودار اولین بار توسط هارولد الینگهام در سال ۱۹۴۴ ابداع شد. [ ۱] در فلزشناسی ( متالورژی ) نمودار الینگهام برای پیش بینی دمای تعادل بین فلز و اکسیژن و اکسید فلز استفاده می شود و در ابعاد گسترده تر واکنش های یک فلز با سولفور، نیتروژن و دیگر مواد غیرفلزی را نیز شامل می شود. این نمودارها در پیش بینی شرایط موردنیاز برای کاهش سنگ معدن به فلز پرکاربرد هستند. تحلیل های برگرفته از نمودار الینگهام در اصل ترمودینامیکی بوده و توجهی به سینتیک شیمیایی ندارند؛ بنابراین فرایندهایی که از بر اساس نمودار امکان پذیر هستد ممکن است در عمل کُند باشند.
نمودار الینگهام یک شکل خاص از اصلی ترمودینامیکی است که می گوید، امکان پذیری ترمودینامیکی یک واکنش وابسته به علامت Δ G ، تغییرات انرژی آزاد گیبس، می باشد که برابر با است با: Δ H − T Δ S که Δ H تغییرت آنتالپی و Δ S تغییرات آنتروپی است.
نمودار الینگهام، تغییر انرژی آزاد گیبس ( Δ G ) را برای هر واکنش اکسیداسیون به عنوان تابعی از دما رسم می کند. برای مقایسه واکنش های مختلف از این فرض استفاده می شود که تمام مقادیر Δ G به مقدار مشابهی از اکسیژن اشاره می کنند. این مقدار را برخی از نویسندگان ۱ مول O ( 1/2 مول O2 ) [ ۲] و برخی دیگر ۱ مول O2 گزارش کرده اند. [ ۳] نمودار نشان داده شده در سمت چپ به ازای ۱ مول O2 رسم شده است. بنابریان به طور مثال خط رسم شده برای اکسیداسیون کروم، Δ G را برای واکنش:
4 3 C r ( s ) + O 2 ( g ) → 2 3 C r 3 O 2 ( s ) برابر با 2/3 انرژی مولی گیبس برای تشکیل Δ G f ∘ ( C r 2 O 3 , s ) می باشد.
در گستره دماهایی که به طور معمول استفاده می شوند، فلز و اکسید فلز حالت فشرده ( مایع یا جامد ) دارند و اکسیژن یک گاز با آنتروپی مولی بسیار بزرگتر می باشد. برای اکسیداسیون هر فلز، تغییر آنتروپی Δ S با حذف 1/2 مول O2 به دست می آید، بنابراین Δ S منفی می باشد و تقریباً برای تمام فلزات برابر است. در نتیجه شیب نمودار d Δ G / d T = − Δ S [ ۲] برای تمام فلزات مثبت است. به علاوه اینکه Δ G دز تمام موارد با کاهش دما منفی تر می شود و خطوط برای تمام اکسیدهای فلزی تقریباً موازی است. از آنجا که این واکنش ها گرمازا ( گرما دهنده ) هستند، در دماهای پایین تر امکان پذیر می باشند. در دماهایی که به مقدار کافی بالا باشند علامت Δ G ممکن است تغییر کند ( منفی شود ) و اکسید فلز خود به خود به فلز تبدیل شود. همان طور که برای Ag و Cu در شکل نشان داده شده است. برای اکسیداسیون کربن، خط قرمز برای تشکیل CO با واکنش: C ( g ) + 1 2 O 2 ( g ) → C O ( g ) نشان داده شده است. خط آبی برای تشکیل CO2 می باشد که تقریباً افقی است زیرا واکنش: C ( s ) + O 2 ( g ) → C O 2 ( g ) منجر به تغییر تعداد مول گاز نمی شود در نتیجه Δ S کوچک است.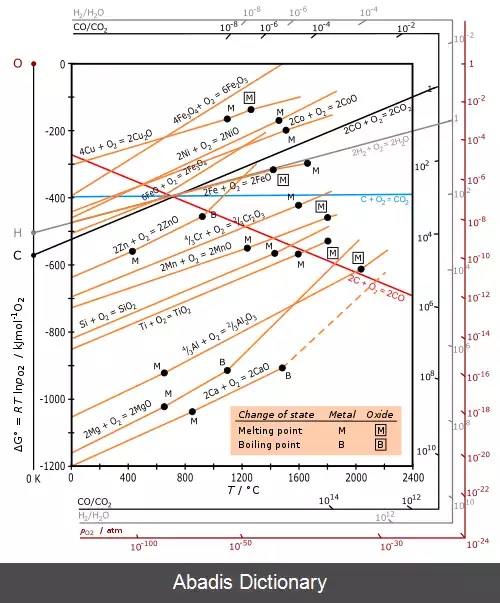

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاین نمودار به رابطه بین این دو مولفه می پردازد. تحلیل هایی که بر اساس نمودار الینگهام انجام می شوند، معمولاً برای سنجش میزان دشواری فرایند کاهش اکسیدهای فلزی و سولفیدها استفاده می شوند. این نمودار اولین بار توسط هارولد الینگهام در سال ۱۹۴۴ ابداع شد. [ ۱] در فلزشناسی ( متالورژی ) نمودار الینگهام برای پیش بینی دمای تعادل بین فلز و اکسیژن و اکسید فلز استفاده می شود و در ابعاد گسترده تر واکنش های یک فلز با سولفور، نیتروژن و دیگر مواد غیرفلزی را نیز شامل می شود. این نمودارها در پیش بینی شرایط موردنیاز برای کاهش سنگ معدن به فلز پرکاربرد هستند. تحلیل های برگرفته از نمودار الینگهام در اصل ترمودینامیکی بوده و توجهی به سینتیک شیمیایی ندارند؛ بنابراین فرایندهایی که از بر اساس نمودار امکان پذیر هستد ممکن است در عمل کُند باشند.
نمودار الینگهام یک شکل خاص از اصلی ترمودینامیکی است که می گوید، امکان پذیری ترمودینامیکی یک واکنش وابسته به علامت Δ G ، تغییرات انرژی آزاد گیبس، می باشد که برابر با است با: Δ H − T Δ S که Δ H تغییرت آنتالپی و Δ S تغییرات آنتروپی است.
نمودار الینگهام، تغییر انرژی آزاد گیبس ( Δ G ) را برای هر واکنش اکسیداسیون به عنوان تابعی از دما رسم می کند. برای مقایسه واکنش های مختلف از این فرض استفاده می شود که تمام مقادیر Δ G به مقدار مشابهی از اکسیژن اشاره می کنند. این مقدار را برخی از نویسندگان ۱ مول O ( 1/2 مول O2 ) [ ۲] و برخی دیگر ۱ مول O2 گزارش کرده اند. [ ۳] نمودار نشان داده شده در سمت چپ به ازای ۱ مول O2 رسم شده است. بنابریان به طور مثال خط رسم شده برای اکسیداسیون کروم، Δ G را برای واکنش:
4 3 C r ( s ) + O 2 ( g ) → 2 3 C r 3 O 2 ( s ) برابر با 2/3 انرژی مولی گیبس برای تشکیل Δ G f ∘ ( C r 2 O 3 , s ) می باشد.
در گستره دماهایی که به طور معمول استفاده می شوند، فلز و اکسید فلز حالت فشرده ( مایع یا جامد ) دارند و اکسیژن یک گاز با آنتروپی مولی بسیار بزرگتر می باشد. برای اکسیداسیون هر فلز، تغییر آنتروپی Δ S با حذف 1/2 مول O2 به دست می آید، بنابراین Δ S منفی می باشد و تقریباً برای تمام فلزات برابر است. در نتیجه شیب نمودار d Δ G / d T = − Δ S [ ۲] برای تمام فلزات مثبت است. به علاوه اینکه Δ G دز تمام موارد با کاهش دما منفی تر می شود و خطوط برای تمام اکسیدهای فلزی تقریباً موازی است. از آنجا که این واکنش ها گرمازا ( گرما دهنده ) هستند، در دماهای پایین تر امکان پذیر می باشند. در دماهایی که به مقدار کافی بالا باشند علامت Δ G ممکن است تغییر کند ( منفی شود ) و اکسید فلز خود به خود به فلز تبدیل شود. همان طور که برای Ag و Cu در شکل نشان داده شده است. برای اکسیداسیون کربن، خط قرمز برای تشکیل CO با واکنش: C ( g ) + 1 2 O 2 ( g ) → C O ( g ) نشان داده شده است. خط آبی برای تشکیل CO2 می باشد که تقریباً افقی است زیرا واکنش: C ( s ) + O 2 ( g ) → C O 2 ( g ) منجر به تغییر تعداد مول گاز نمی شود در نتیجه Δ S کوچک است.


wiki: نمودار الینگهام
