معادله آرنیوس. معادله آرنیوس فرمولی برای وابستگی نرخ واکنش شیمیایی به دما می باشد. این فرمول توسط سوانت آرنیوس در سال ۱۸۸۹ پیشنهاد شد. این فرمول کاربردهای وسیع و مهمی را درتعیین نرخ واکنش های شیمیایی و محاسبه انرژی فعال سازی دارد. آرنیوس توجیه فیزیکی و تفسیر برای فرمول ارائه داد. [ ۱] [ ۲] [ ۳] در حال حاضر، این رابطه به عنوان یک رابطه تجربی شناخته می شود. [ ۴]
معادله آرنیوس en:Arrhenius equation
جایی که:
• k نرخ ثابت
• T دمای مطلق برحسب کلوین
• A فاکتور احتمال شکل مولکول و عوامل دخیل در برخورد و جاذبه های مولکولی و. . .
• Ea انرژی آزاد سازی ژول
• R iثابت جهانی گازها:[ ۵] [ ۶] [ ۷]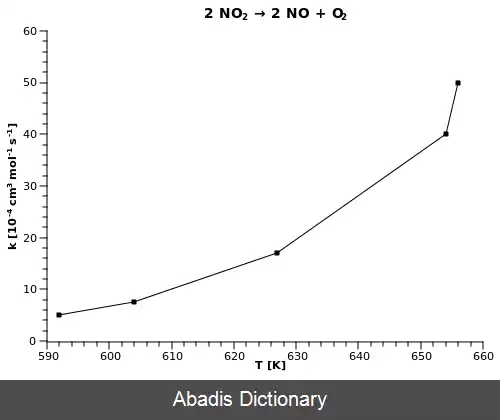
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفمعادله آرنیوس en:Arrhenius equation
جایی که:
• k نرخ ثابت
• T دمای مطلق برحسب کلوین
• A فاکتور احتمال شکل مولکول و عوامل دخیل در برخورد و جاذبه های مولکولی و. . .
• Ea انرژی آزاد سازی ژول
• R iثابت جهانی گازها:[ ۵] [ ۶] [ ۷]

wiki: معادله آرنیوس
