قانون هس ( به انگلیسی: Hess's law ) بیانگر این نکته است که گرمای آزاد شده یا جذب شده در یک واکنش شیمیایی به تعداد مراحل انجام واکنش وابسته نبوده اگر واکنش در یک یا چند مرحله انجام شود، این مقدار یکسان خواهد بود.
با استفاده از این قانون می توان گرمای واکنش هایی که شرایط انجام آن ها سخت بوده یا اندازه گیری گرما در آن ها امکان پذیر نیست، را محاسبه کرد. با استفاده از این قانون می توان با داشتن انتالپی واکنشهای حد واسط انتالپی واکنش کلی را به دست اورد
گاز هیدروژن که به عنوان یک سوخت پاک نیز از آن بهره می گیرند، به کمک واکنش کربن ( زغال ) و آب بوجود می آید:
C ( s ) +2H2O ( g ) →CO2 ( g ) +2H2 ( g )
محاسبات نشان می دهند که برای مصرف هر مول کربن، به میزان 90. 1kJ گرما نیاز داریم. به طور قراردادی، زمانی که گرما در طول یک واکنش جذب شود، علامت آن را مثبت در نظر می گیریم. به بیان دیگر، در یک واکنش گرماگیر q> 0 و در یک واکنش گرماده q< 0 خواهد بود.
ممکن است این سوال پیش بیاید که چه اتفاقی برای انرژی وارد شده به سیستم خواهد افتاد. یک راه پاسخ این است که بگوییم این انرژی صرف تبدیل یک سوخت ( کربن ) به سوخت دیگر ( هیدروژن ) شده است. برای مقایسه انرژی در هر سوخت، می توانیم گرمای حاصل از احتراق هر سوخت با یک مول از اکسیژن را حساب کنیم:
C ( s ) +O2 ( g ) →CO2 ( g )
واکنش بالا در ازای سوختن یک مول از کربن میزان 393. 5kJ انرژی تولید می کند. بنابراین خواهیم داشت:
q=−393. 5kJ
همچنین در واکنش زیر، به ازای سوختن دو مول گاز هیدروژن میزان 483. 6 kJ گرما تولید می شود. در نتیجه برای این تغییر شیمیایی خواهیم داشت q=–483. 6 kJ که معادله آن در زیر آمده است:
2H2 ( g ) +O2 ( g ) →2H2O ( g )
• مشارکت کنندگان ویکی پدیا. «Hess's law». در دانشنامهٔ ویکی پدیای انگلیسی، بازبینی شده در ۲۶ فوریه ۲۰۱۴.
• ترمودینامیک شیمیایی
• شیمی حرارتی
• قانون های پایستگی
• قانون
• مقاله های نیازمند گسترش
• مقاله های دارای واژگان به زبان انگلیسی
• مقاله های دارای الگوی یادکرد - ویکی
• همه مقاله های خرد
• مقاله های خرد شیمی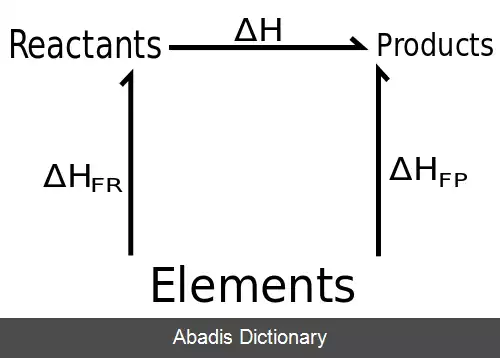
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفبا استفاده از این قانون می توان گرمای واکنش هایی که شرایط انجام آن ها سخت بوده یا اندازه گیری گرما در آن ها امکان پذیر نیست، را محاسبه کرد. با استفاده از این قانون می توان با داشتن انتالپی واکنشهای حد واسط انتالپی واکنش کلی را به دست اورد
گاز هیدروژن که به عنوان یک سوخت پاک نیز از آن بهره می گیرند، به کمک واکنش کربن ( زغال ) و آب بوجود می آید:
C ( s ) +2H2O ( g ) →CO2 ( g ) +2H2 ( g )
محاسبات نشان می دهند که برای مصرف هر مول کربن، به میزان 90. 1kJ گرما نیاز داریم. به طور قراردادی، زمانی که گرما در طول یک واکنش جذب شود، علامت آن را مثبت در نظر می گیریم. به بیان دیگر، در یک واکنش گرماگیر q> 0 و در یک واکنش گرماده q< 0 خواهد بود.
ممکن است این سوال پیش بیاید که چه اتفاقی برای انرژی وارد شده به سیستم خواهد افتاد. یک راه پاسخ این است که بگوییم این انرژی صرف تبدیل یک سوخت ( کربن ) به سوخت دیگر ( هیدروژن ) شده است. برای مقایسه انرژی در هر سوخت، می توانیم گرمای حاصل از احتراق هر سوخت با یک مول از اکسیژن را حساب کنیم:
C ( s ) +O2 ( g ) →CO2 ( g )
واکنش بالا در ازای سوختن یک مول از کربن میزان 393. 5kJ انرژی تولید می کند. بنابراین خواهیم داشت:
q=−393. 5kJ
همچنین در واکنش زیر، به ازای سوختن دو مول گاز هیدروژن میزان 483. 6 kJ گرما تولید می شود. در نتیجه برای این تغییر شیمیایی خواهیم داشت q=–483. 6 kJ که معادله آن در زیر آمده است:
2H2 ( g ) +O2 ( g ) →2H2O ( g )
• مشارکت کنندگان ویکی پدیا. «Hess's law». در دانشنامهٔ ویکی پدیای انگلیسی، بازبینی شده در ۲۶ فوریه ۲۰۱۴.
• ترمودینامیک شیمیایی
• شیمی حرارتی
• قانون های پایستگی
• قانون
• مقاله های نیازمند گسترش
• مقاله های دارای واژگان به زبان انگلیسی
• مقاله های دارای الگوی یادکرد - ویکی
• همه مقاله های خرد
• مقاله های خرد شیمی

wiki: قانون هس
