فنول ها یا فنولیک ها ( به انگلیسی: phenolics ) در دسته بندی ترکیبات آلی به دسته ای از ترکیبات گفته می شود که در آن یک گروه عاملی هیدروکسیل ( —OH ) به طور مستقیم به یک هیدروکربن آروماتیک متصل باشد. [ ۱] [ ۲] [ ۳] نکته قابل توجه در مورد این ترکیبات این است که با وجود گروه عاملی هیدروکسیل، این ترکیبات جزو دستهٔ الکل ها طبقه بندی نمی شوند. از جمله ویژگی های منحصر به فرد آن نیز اسیدیته بالای این ترکیبات است. فنول ها به علت دارا بودن گروه هیدروکسی تا حدودی مشابه با الکل ها هستند. فنول ها معمولاً دارای نقطه ذوب پایینی هستند، اما به علت امکان تشکیل پیوندهای هیدروژنی نقطه جوش بالایی دارند. فنول به دلیل تشکیل پیوند هیدروژنی در آب محلول است ولی بیشتر مشتق های آن در آب کم محلول یا نامحلول هستند. بسیاری از مشتق های فنولی کاربرد دارویی و صنعتی دارد. فنول نسبت به حلقه بنزن بسیار فعال تر بوده و به راحتی در واکنش های جانشینی الکترون دوستی حلقه شرکت می کند. همان طور که در واکنش بالا نیز مشخص گردیده است، انجام واکنش برم دار کردن فنول نیازی به کاتالیزور اسید لوئیس ندارد و واکنش، تا برم دار شدن کامل حلقه پیش می رود. انجام واکنش نیتراسیون نیز در شرایط ملایم تری نسبت به بنزن رخ می دهد. یکی از واکنش های معروف در مورد فنول، واکنش کولب می باشد که طی آن 2 - هیدروکسی بنزوئیک اسید یا سالیسیلیک اسید که ماده اولیه تولید آسپیرین می باشد، تولید می گردد. در اثر واکنش باز با فنول و به علت خاصیت اسیدی هیدروژن فنولی، یون فنوکسید ایجاد می گردد. آنیون فنوکسید حاصل می تواند با حلقه بنزن رزونانس کند. یون فنوکسید حاصل در ادامه به CO2 حمله می کند و در نهایت با اسیدی کردن محیط محصول نهایی که همان 2 - هیدروکسی بنزوئیک اسید می باشد، حاصل می گردد. به طور کلی مکانسیم واکنش به صورت زیر می باشد. فنول تا حدودی خاصیت اسیدی دارد و در حضور آب پروتون از دست می دهد و به یون فنوکسید تبدیل می گردد. به طور کلی قرار گرفتن گروه های الکترون کشنده بر روی حلقه، خاصیت اسیدی فنول را افزایش و قرار گرفتن گروه های الکترون دهنده خاصیت اسیدی را کاهش می دهد. همچنین یون فنوکسید می تواند طی یک واکنش SN2 و با در حضور ترکیبی با ترک کننده مناسب، آریل اتر تولید کند.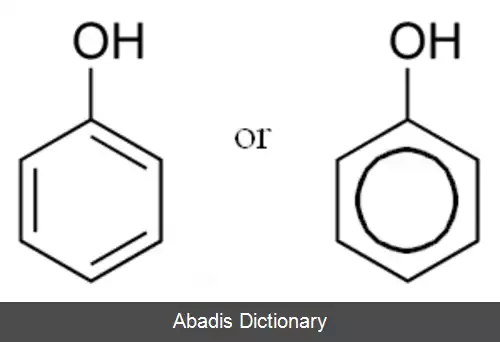
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلف

wiki: فنول ها
