زمانی که سیال در یک محفظه سربسته قرار داده می شود، فشار جزئی سیال در لحظات اولیه بالای مایع ( قسمت خالی محفظه ) تقریباً برابر با صفر است. دلیل این موضوع این است که هنوز هیچ مولکول اضافی در فاز بخار مجود نیست. در این حالت، تعدای از مولکول ها در سطح این مایع حضور دارند که دارای انرژی جنبشی کافی برای فرار از سطح و تبدیل شدن به بخار هستند. بنابراین فشار نسبی قسمت خالی محفظه آرام آرام افزایش می یابد. تحت این شرایط و به محض اینکه بخار تشکیل شود، بخشی از مولکول هایی که در فاز بخار هستند، با سطح مایع برخورد می کنند و دوباره به فاز مایع باز می گردند. این فرایند تحت عنوان میعان شناخته می شود. به فشار قسمت خالی محفظه در این حالت، فشار بخار اشباع گفته می شود.
علاوه بر تغییر دما، با تغییر فشار هم می توان، فرآیند تغییر فاز را انجام داد. در دمای مشخص، فشاری که در آن فرآیند تغییر فاز رخ می دهد فشار اشباع نامیده می شود. به عنوان نمونه آب در دمای ۲۵ درجه سانتی گراد، با فشار محیط ۳٫۱۷ کیلوپاسکال شروع به تغییر فاز می کند. همانند مواد دیگر، فشار بخار اشباع تابعی از دما است و می تواند با رابطه کلازیوس – کلاپیرون آن را اندازه گیری کرد. با افزایش فشار، حجم مخصوص مایع اشباع و بخار اشباع به هم نزدیک می شوند تا جایی که در فشار بحرانی، حجم مخصوص بخار اشباع و مایع اشباع با یکدیگر برابر خواهند شد. در فشارهای بیش از فشار بحرانی فرآیند تغییر فاز دیگر رخ نخواهد داد و در هر لحظه فقط یک فاز مشاهده خواهد شد: یا مایع متراکم یا بخار مافوق گرم [ ۱] .
فشار بخار اشباع آب با رابطهٔ زیر تقریب زده می شود ( بر اساس دستور افزایش دقت ) :
• P فشار بخار اشباع آب بر حسب ( mmHg ) و T بر حسب کلوین می باشد.
• با استفاده از معادله آنتوان:
• در حالی که دما بر حسب درجه سلسیوس و فشاربخار آب P بر حسب ( mmHg ) است. و ثابت ها را به صورت زیر بگیرید.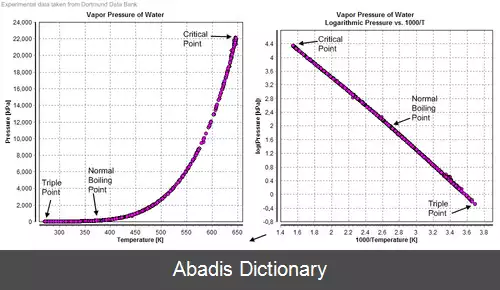
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفعلاوه بر تغییر دما، با تغییر فشار هم می توان، فرآیند تغییر فاز را انجام داد. در دمای مشخص، فشاری که در آن فرآیند تغییر فاز رخ می دهد فشار اشباع نامیده می شود. به عنوان نمونه آب در دمای ۲۵ درجه سانتی گراد، با فشار محیط ۳٫۱۷ کیلوپاسکال شروع به تغییر فاز می کند. همانند مواد دیگر، فشار بخار اشباع تابعی از دما است و می تواند با رابطه کلازیوس – کلاپیرون آن را اندازه گیری کرد. با افزایش فشار، حجم مخصوص مایع اشباع و بخار اشباع به هم نزدیک می شوند تا جایی که در فشار بحرانی، حجم مخصوص بخار اشباع و مایع اشباع با یکدیگر برابر خواهند شد. در فشارهای بیش از فشار بحرانی فرآیند تغییر فاز دیگر رخ نخواهد داد و در هر لحظه فقط یک فاز مشاهده خواهد شد: یا مایع متراکم یا بخار مافوق گرم [ ۱] .
فشار بخار اشباع آب با رابطهٔ زیر تقریب زده می شود ( بر اساس دستور افزایش دقت ) :
• P فشار بخار اشباع آب بر حسب ( mmHg ) و T بر حسب کلوین می باشد.
• با استفاده از معادله آنتوان:
• در حالی که دما بر حسب درجه سلسیوس و فشاربخار آب P بر حسب ( mmHg ) است. و ثابت ها را به صورت زیر بگیرید.

wiki: فشار بخار اشباع
