فرایند هم فشار
فرهنگستان زبان و ادب
دانشنامه عمومی
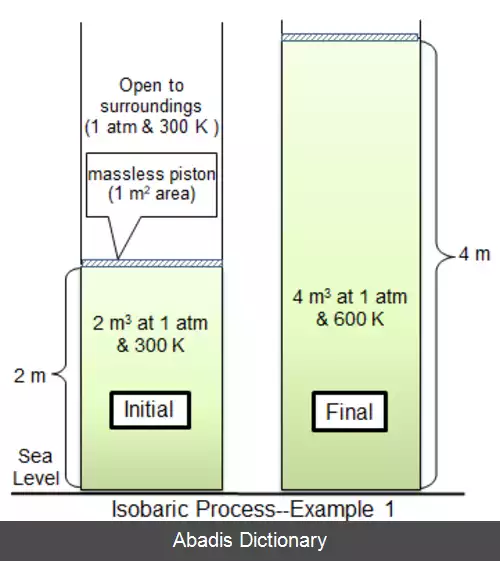
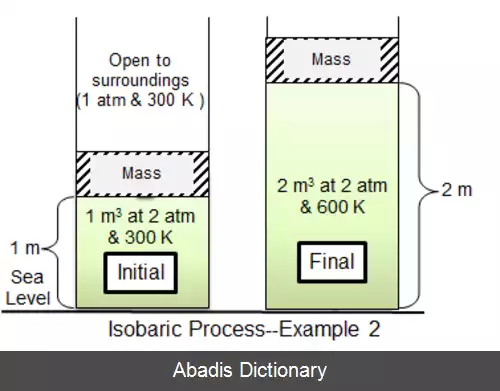
در ترمودینامیک، فرآیند هم فشار یا فرآیند ایزوباریک فرآیندی است، که در آن فشار سیستم ثابت می ماند: Δ p = 0 . گرمای منتقل شده به سیستم کار انجام می دهد. این گرمای منتقل شده، انرژی داخلی ( U ) سیستم را نیز تغییر می دهد.
در این مقاله از قرارداد علامت فیزیکی برای کار استفاده می شود. طبق این قرارداد، کار مثبت توسط سیستم انجام می شود. با استفاده از این قرارداد، طبق قانون اول ترمودینامیک:
Q = Δ U + W
در این فرمول W کار است، U انرژی درونی است و Q گرما است. [ ۱] کار انجام شده توسط سیستم بسته، به صورت زیر تعریف می شود:
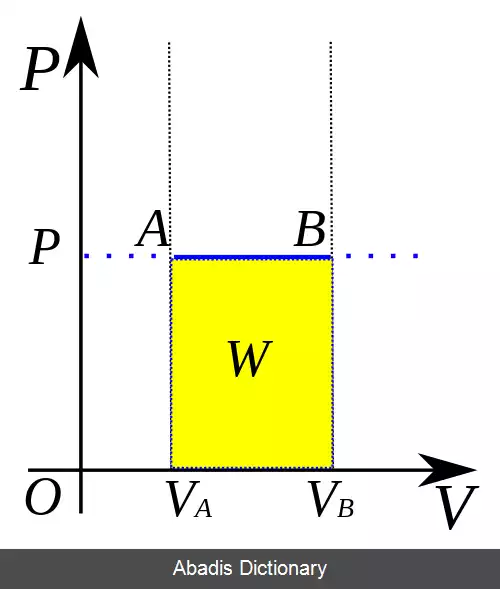
W = ∫ p d V
در روابط d نشان دهنده دیفرانسیل است، درحالی که Δ به معنای تغییر در کل فرآیند است. از آنجا که فشار ثابت است:
W = − p Δ V
با استفاده از قانون گازهای ایده آل، رابطه ی زیر به دست می آید:
W = − n R Δ T
R نشان دهنده ثابت گازها و n نشان دهنده مقدار ماده است. فرض می شود که n در طی فرآیند ثابت باقی می ماند. ( به عنوان مثال، هیچ انتقال فاز در طی واکنش شیمیایی وجود ندارد ) با توجه به قضیه همپاری، [ ۲] تغییر در انرژی داخلی توسط رابطه ی زیر، به دمای سیستم مربوط می شود.
Δ U = n c V , m Δ T
به طوری که c V , m ، ظرفیت گرمایی مولی در یک حجم ثابت است.
جایگزینی دو معادله آخر در اولین معادله، معادله های زیر را تولید می کند:
Q = n c V , m Δ T + n R Δ T
Q = n Δ T ( c V , m + R )
Q = n Δ T c P , m
که در آن c p ظرفیت گرمایی مولی در فشار ثابت است.
برای یافتن ظرفیت گرمایی مولی ویژه گاز درگیر، معادلات زیر برای هر گاز عمومی که از نظر کالری کامل باشد، اعمال می شود. خاصیت γ، شاخص آدیاباتیک یا نسبت ظرفیت گرمایی نامیده می شود. برخی از منابع منتشر شده ممکن است به جای γ از k استفاده کنند.
گرمای ویژه مولی فرآیند هم حجم:
c V = R γ − 1
گرمای ویژه مولی هم فشار:
c p = γ R γ − 1
مقادیر γ برای گازهای دواتمی مانند هوا و اجزای اصلی آن γ = 7 5 و برای گازهای تک اتمی مانند گازهای نجیب γ = 5 3 است. فرمول های مربوط به گرماهای ویژه در این موارد خاص به این صورت است:
تک اتمی: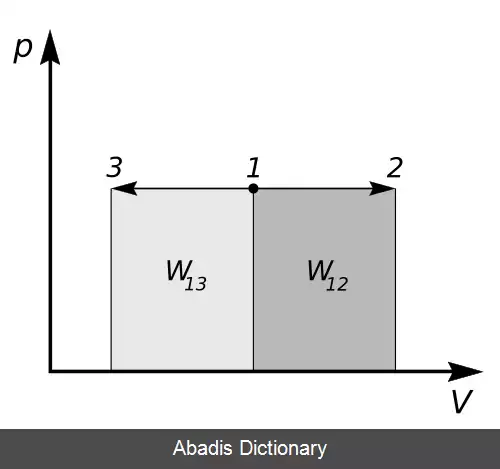
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر این مقاله از قرارداد علامت فیزیکی برای کار استفاده می شود. طبق این قرارداد، کار مثبت توسط سیستم انجام می شود. با استفاده از این قرارداد، طبق قانون اول ترمودینامیک:
Q = Δ U + W
در این فرمول W کار است، U انرژی درونی است و Q گرما است. [ ۱] کار انجام شده توسط سیستم بسته، به صورت زیر تعریف می شود:
W = ∫ p d V
در روابط d نشان دهنده دیفرانسیل است، درحالی که Δ به معنای تغییر در کل فرآیند است. از آنجا که فشار ثابت است:
W = − p Δ V
با استفاده از قانون گازهای ایده آل، رابطه ی زیر به دست می آید:
W = − n R Δ T
R نشان دهنده ثابت گازها و n نشان دهنده مقدار ماده است. فرض می شود که n در طی فرآیند ثابت باقی می ماند. ( به عنوان مثال، هیچ انتقال فاز در طی واکنش شیمیایی وجود ندارد ) با توجه به قضیه همپاری، [ ۲] تغییر در انرژی داخلی توسط رابطه ی زیر، به دمای سیستم مربوط می شود.
Δ U = n c V , m Δ T
به طوری که c V , m ، ظرفیت گرمایی مولی در یک حجم ثابت است.
جایگزینی دو معادله آخر در اولین معادله، معادله های زیر را تولید می کند:
Q = n c V , m Δ T + n R Δ T
Q = n Δ T ( c V , m + R )
Q = n Δ T c P , m
که در آن c p ظرفیت گرمایی مولی در فشار ثابت است.
برای یافتن ظرفیت گرمایی مولی ویژه گاز درگیر، معادلات زیر برای هر گاز عمومی که از نظر کالری کامل باشد، اعمال می شود. خاصیت γ، شاخص آدیاباتیک یا نسبت ظرفیت گرمایی نامیده می شود. برخی از منابع منتشر شده ممکن است به جای γ از k استفاده کنند.
گرمای ویژه مولی فرآیند هم حجم:
c V = R γ − 1
گرمای ویژه مولی هم فشار:
c p = γ R γ − 1
مقادیر γ برای گازهای دواتمی مانند هوا و اجزای اصلی آن γ = 7 5 و برای گازهای تک اتمی مانند گازهای نجیب γ = 5 3 است. فرمول های مربوط به گرماهای ویژه در این موارد خاص به این صورت است:
تک اتمی:





wiki: فرایند هم فشار
پیشنهاد کاربران
پیشنهادی ثبت نشده است. شما اولین نفر باشید
