فرایند هم دما
فرهنگستان زبان و ادب
دانشنامه عمومی
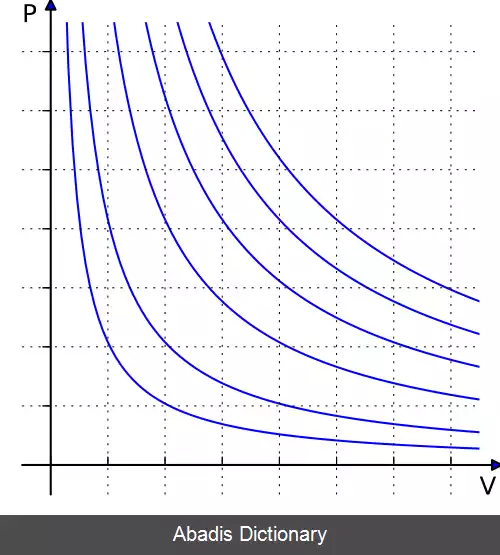
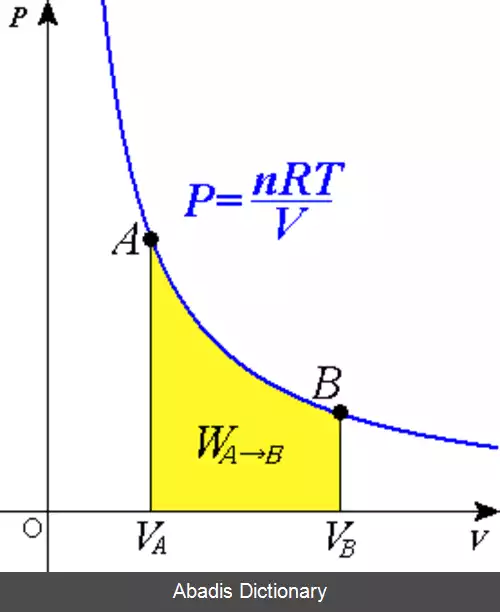
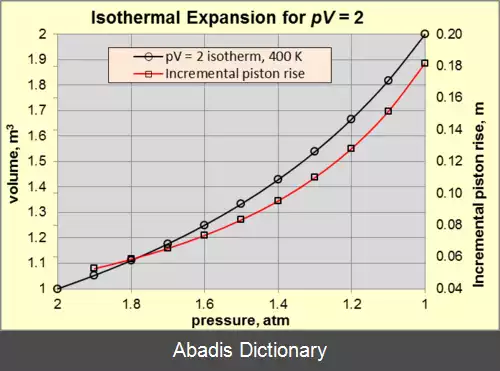
در ترمودینامیک، فرآیند هم دما ( isothermal process ) فرآیندی است که در آن دمای سیستم ثابت می ماند : Δ T = 0 .
این حالت زمانی رخ می دهد که سیستم در تماس با یک منبع حرارتی خارجی قرار دارد، و تغییرات سیستم به حدی آرام رخ می دهند که به سیستم این اجازه را می دهند که از طریق مبادله ی گرما، دمای خود را با منبع حرارتی تنظیم کند. در نقطه مقابل، فرآیند بی دررو فرآیندی است که در طی آن سیستم هیچ تبادل گرمایی با محیط پیرامون ندارد ( Q = 0 ) .
به طور خلاصه می توان گفت که در فرآیند هم دما :
• T = constant {\displaystyle T={\text{constant}}} ( دما )
• Δ T = 0 {\displaystyle \Delta T=0}
• d T = 0 {\displaystyle dT=0}
فقط برای گازهای ایده آل : Δ U = 0 ( انرژی درونی )
فرآیندهای هم دما می توانند در هر سیستمی که به نوعی سامانه تنظیم دما دسترسی دارد، رخ دهند ( از جمله: ماشین آلات بسیار پیچیده از لحاظ ساختاری و حتی سلول های زنده ) . بعضی از قسمت های چرخه بعضی از موتورهای گرمایی به صورت هم دما ( isothermal ) انجام می شوند ( به عنوان مثال در چرخه کارنو ) . [ ۱] در تجزیه و تحلیل ترمودینامیکی واکنش های شیمیایی، معمولاً ابتدا آنچه در شرایط هم دما ( دما ثابت ) اتفاق می افتد را تجزیه و تحلیل کرده و سپس اثر دما را در نظر می گیرند. [ ۲] تغییرات فاز ( مانند ذوب شدن یا تبخیر ) نیز وقتی در فشار ثابت اتفاق می افتند، فرایندهایی هم دما محسوب می شوند. [ ۳] فرآیندهای هم دما به وفور مورد استفاده قرار گرفته و به نوعی، یک نقطه شروع در تجزیه و تحلیل فرایندهای پیچیده تر و غیر هم دما هستند.
فرآیندهای هم دما در مبحث گازهای ایده آل مورد توجه ویژه ای قرار دارند. این نتیجه قانون دوم ژول است که می گوید: انرژی درونی مقدار ثابتی از یک گاز ایده آل فقط به دمای آن بستگی دارد. [ ۴] بنابراین، در یک فرآیند هم دما، انرژی درونی یک گاز ایده آل ثابت است. این نتیجه را می توان از این حقیقت که در یک گاز ایده آل هیچ نیروی بین مولکولی وجود ندارد، برداشت کرد. [ ۴] توجه داشته باشید که این فقط در مورد گازهای ایده آل صادق می باشد. در مایعات ، جامدات و گازهای واقعی، انرژی درونی علاوه بر دما ( درجه حرارت ) به فشار نیز بستگی دارد. [ ۵]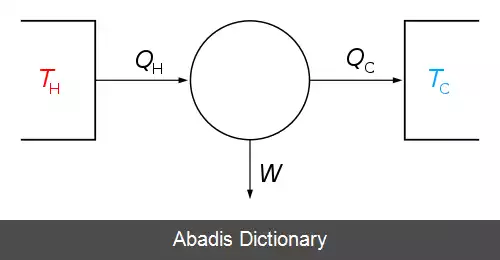
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاین حالت زمانی رخ می دهد که سیستم در تماس با یک منبع حرارتی خارجی قرار دارد، و تغییرات سیستم به حدی آرام رخ می دهند که به سیستم این اجازه را می دهند که از طریق مبادله ی گرما، دمای خود را با منبع حرارتی تنظیم کند. در نقطه مقابل، فرآیند بی دررو فرآیندی است که در طی آن سیستم هیچ تبادل گرمایی با محیط پیرامون ندارد ( Q = 0 ) .
به طور خلاصه می توان گفت که در فرآیند هم دما :
• T = constant {\displaystyle T={\text{constant}}} ( دما )
• Δ T = 0 {\displaystyle \Delta T=0}
• d T = 0 {\displaystyle dT=0}
فقط برای گازهای ایده آل : Δ U = 0 ( انرژی درونی )
فرآیندهای هم دما می توانند در هر سیستمی که به نوعی سامانه تنظیم دما دسترسی دارد، رخ دهند ( از جمله: ماشین آلات بسیار پیچیده از لحاظ ساختاری و حتی سلول های زنده ) . بعضی از قسمت های چرخه بعضی از موتورهای گرمایی به صورت هم دما ( isothermal ) انجام می شوند ( به عنوان مثال در چرخه کارنو ) . [ ۱] در تجزیه و تحلیل ترمودینامیکی واکنش های شیمیایی، معمولاً ابتدا آنچه در شرایط هم دما ( دما ثابت ) اتفاق می افتد را تجزیه و تحلیل کرده و سپس اثر دما را در نظر می گیرند. [ ۲] تغییرات فاز ( مانند ذوب شدن یا تبخیر ) نیز وقتی در فشار ثابت اتفاق می افتند، فرایندهایی هم دما محسوب می شوند. [ ۳] فرآیندهای هم دما به وفور مورد استفاده قرار گرفته و به نوعی، یک نقطه شروع در تجزیه و تحلیل فرایندهای پیچیده تر و غیر هم دما هستند.
فرآیندهای هم دما در مبحث گازهای ایده آل مورد توجه ویژه ای قرار دارند. این نتیجه قانون دوم ژول است که می گوید: انرژی درونی مقدار ثابتی از یک گاز ایده آل فقط به دمای آن بستگی دارد. [ ۴] بنابراین، در یک فرآیند هم دما، انرژی درونی یک گاز ایده آل ثابت است. این نتیجه را می توان از این حقیقت که در یک گاز ایده آل هیچ نیروی بین مولکولی وجود ندارد، برداشت کرد. [ ۴] توجه داشته باشید که این فقط در مورد گازهای ایده آل صادق می باشد. در مایعات ، جامدات و گازهای واقعی، انرژی درونی علاوه بر دما ( درجه حرارت ) به فشار نیز بستگی دارد. [ ۵]




wiki: فرایند هم دما
پیشنهاد کاربران
پیشنهادی ثبت نشده است. شما اولین نفر باشید
