فرایند هال–هرولت ( به انگلیسی: Hall–Héroult process ) که با نام فرایند هال نیز شناخته می شود، فرایندی صنعتی جهت تولید انبوه فلز آلومینیم به روش الکترولیز است. این روش نخستین بار توسط دو دانشمند به نام های چارلز مارتین هال و پائول هرولت در سال ۱۸۸۶ میلادی ابداع گردید. [ ۱] این فرایند از طریق انتشار کربن دی اکسید در واکنش الکترولیتی به تغییرات آب و هوایی کمک می کند. [ ۲]
در حالت معمول آلومینیم اکسید که ماده اولیه تولید فلز آلومینیم است در دمای ۲۰۷۲ درجه سانتی گراد ذوب می شود که تأمین این دما از نظر اقتصادی بسیار گران است. ایده هال و هرولت این بود که در صورت افزودن مقداری کریولیت به مواد الکترولیت، می توان دمای ذوب مخلوط را تا ۹۶۰ درجه سانتی گراد تقلیل داد.
واکنش کلی که منجر به تخلیص آلومینیم در فرایند هال می شود به شرح زیر است:[ ۳]
آلومینیوم اولیه را نمی توان با الکترولیز نمک آبی آلومینیوم تولید کرد، زیرا یون های هیدرونیوم به راحتی آلومینیوم اولیه را اکسید می کند. اگرچه به جای آن می توان از نمک آلومینیوم مذاب استفاده کرد، اکسید آلومینیوم دارای نقطه ذوب ۲۰۷۲ سلسیوس است، [ ۴] بنابراین الکترولیز آن غیر عملی است. در فرایند هال هرولت، آلومینا، Al2O3 در کرولیت مصنوعی مذاب، Na3AlF6 حل می شود تا نقطه ذوب آن برای الکترولیز آسان تر شود. [ ۵] منبع کربن به طوری کلی یک کک ( نوعی سوخت فسیلی ) است. [ ۶]
در فرایند هال - هرولت واکنشهای ساده زیر در الکترودهای کربن اتفاق می افتد:
کاتد:
آند:
به طور کلی:
در حقیقت CO2 بسیار بیشتر از CO در آند تشکیل می شود:
کریولیت خالص دارای نقطه ذوب ۷۰۰۳۱۲۸۲۱۵۰۰۰۰۰۰۰۰۰♠۱۰۰۹±۱ °C است. با درصد کمی آلومینا که در آن محلول است، نقطه ذوب آن به حدود ۱۰۰۰ سلسیوس کاهش می یابد. علاوه بر این که از نقطه ذوب نسبتاً کمی برخوردار است، از کریولیت به عنوان الکترولیت استفاده می شود زیرا علاوه بر این، آلومینا را به خوبی حل می کند، الکتریسیته را هدایت می کند، در ولتاژ بالاتر از آلومینا به صورت الکترولیتی جدا می شود و همچنین در دمای مورد نیاز الکترولیز، دارای تراکم کمتری نسبت به آلومینیوم است. [ ۵]
آلومینیوم فلوراید ( AlF3 ) معمولاً به الکترولیت اضافه می شود. نسبت NaF/AlF3 را نسبت کریولیت می نامند و در کریولیت خالص ۳ است. در تولیدات صنعتی، AlF3 به این ترتیب اضافه می شود که نسبت کریولیت ۲–۳ باشد تا نقطه ذوب بیشتر کاهش یابد، بنابراین الکترولیز می تواند در دمای بین ۹۴۰ تا ۹۸۰ °C اتفاق بیافتد. چگالی آلومینیوم مایع در دمای بین ۹۵۰ تا ۱۰۰۰ سلسیوس g/ml 2. 3 است. چگالی الکترولیت باید کمتر از ۲٫۱ گرم بر میلی لیتر باشد، به طوری که آلومینیوم مذاب از الکترولیت جدا شده و در پایین سلول الکترولیز ته نشین می شود. علاوه بر AlF3، مواد افزودنی دیگری مانند لیتیوم فلوراید ممکن است برای تغییر خواص مختلف ( نقطه ذوب، چگالی و غیره ) به الکترولیت اضافه شود. [ ۵]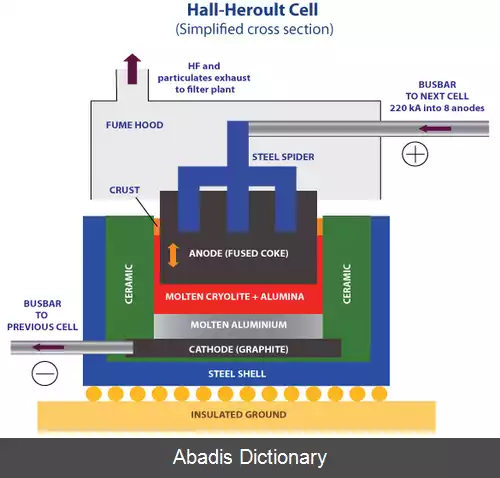

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر حالت معمول آلومینیم اکسید که ماده اولیه تولید فلز آلومینیم است در دمای ۲۰۷۲ درجه سانتی گراد ذوب می شود که تأمین این دما از نظر اقتصادی بسیار گران است. ایده هال و هرولت این بود که در صورت افزودن مقداری کریولیت به مواد الکترولیت، می توان دمای ذوب مخلوط را تا ۹۶۰ درجه سانتی گراد تقلیل داد.
واکنش کلی که منجر به تخلیص آلومینیم در فرایند هال می شود به شرح زیر است:[ ۳]
آلومینیوم اولیه را نمی توان با الکترولیز نمک آبی آلومینیوم تولید کرد، زیرا یون های هیدرونیوم به راحتی آلومینیوم اولیه را اکسید می کند. اگرچه به جای آن می توان از نمک آلومینیوم مذاب استفاده کرد، اکسید آلومینیوم دارای نقطه ذوب ۲۰۷۲ سلسیوس است، [ ۴] بنابراین الکترولیز آن غیر عملی است. در فرایند هال هرولت، آلومینا، Al2O3 در کرولیت مصنوعی مذاب، Na3AlF6 حل می شود تا نقطه ذوب آن برای الکترولیز آسان تر شود. [ ۵] منبع کربن به طوری کلی یک کک ( نوعی سوخت فسیلی ) است. [ ۶]
در فرایند هال - هرولت واکنشهای ساده زیر در الکترودهای کربن اتفاق می افتد:
کاتد:
آند:
به طور کلی:
در حقیقت CO2 بسیار بیشتر از CO در آند تشکیل می شود:
کریولیت خالص دارای نقطه ذوب ۷۰۰۳۱۲۸۲۱۵۰۰۰۰۰۰۰۰۰♠۱۰۰۹±۱ °C است. با درصد کمی آلومینا که در آن محلول است، نقطه ذوب آن به حدود ۱۰۰۰ سلسیوس کاهش می یابد. علاوه بر این که از نقطه ذوب نسبتاً کمی برخوردار است، از کریولیت به عنوان الکترولیت استفاده می شود زیرا علاوه بر این، آلومینا را به خوبی حل می کند، الکتریسیته را هدایت می کند، در ولتاژ بالاتر از آلومینا به صورت الکترولیتی جدا می شود و همچنین در دمای مورد نیاز الکترولیز، دارای تراکم کمتری نسبت به آلومینیوم است. [ ۵]
آلومینیوم فلوراید ( AlF3 ) معمولاً به الکترولیت اضافه می شود. نسبت NaF/AlF3 را نسبت کریولیت می نامند و در کریولیت خالص ۳ است. در تولیدات صنعتی، AlF3 به این ترتیب اضافه می شود که نسبت کریولیت ۲–۳ باشد تا نقطه ذوب بیشتر کاهش یابد، بنابراین الکترولیز می تواند در دمای بین ۹۴۰ تا ۹۸۰ °C اتفاق بیافتد. چگالی آلومینیوم مایع در دمای بین ۹۵۰ تا ۱۰۰۰ سلسیوس g/ml 2. 3 است. چگالی الکترولیت باید کمتر از ۲٫۱ گرم بر میلی لیتر باشد، به طوری که آلومینیوم مذاب از الکترولیت جدا شده و در پایین سلول الکترولیز ته نشین می شود. علاوه بر AlF3، مواد افزودنی دیگری مانند لیتیوم فلوراید ممکن است برای تغییر خواص مختلف ( نقطه ذوب، چگالی و غیره ) به الکترولیت اضافه شود. [ ۵]


wiki: فرایند هال–هرولت
