سدیم بورو هیدرید، یا سدیم تترا هیدرو بورات، ترکیبی معدنی با فرمولاسیون NaBH4 است. این جامد سفید رنگ معمولاً به صورت پودری بوده و به عنوان عامل کاهنده در کاربردهای شیمیایی در دو مقیاس آزمایشگاهی و صنعتی استفاده می شود. این ماده در ساخت خمیر چوب کاربرد دارد، ولی به دلیل هزینه ی بالای آن در صنعت چوب از آن استفاده نمی شود. این ترکیب در الکل ها، در برخی از اترها و در آب حل می شود، اگرچه به آهستگی هیدرولیز می شود.
این ترکیب در دهه ی 1940 به وسیلهٔ ی H. I. Schlesinger کشف شد. H. I. Schlesinger به دنبال یافتن ترکیبات قرار اورانیوم بود. نتایج این تحقیق در سال 1953 از حالت محرمانه خارج شده و منتشر شد.
سدیم بورو هیدرید پودری میکرو کریستالی بی بو به رنگ سفید و یا خاکستری مایل به سفید است که از حالت توده ی آن تهیه می شود. این ماده با استفاده از کریستالیزاسیون دوباره از دیگلیم گرم در دمای 50 درجه ی سانتیگراد تخلیص می شود. سدیم بورو هیدرید در حلالهای پروتیک از قبیل الکل و آب قابل حل است. ترکیب سدیم بوروهیدرید با این حلالهای پروتیک باعث تولید مولکول هیدروژن می شود، اگرچه این واکنشها به نسبت آرام است. تجزیه ی کامل محلول متانول نزدیک به 90 دقیقه در دمای بیست درجه ی سانتیگراد طول میکشد. این ترکیب در محلولهای آبی خنثی و یا اسیدی تجزیه می شود، اما در pH=14 پایدار است.
سدیم بوروهیدرید یک ترکیب نمکی است که ار آنیون های تتراهدرال - BH4 تشکیل شده است. این ماده ی جامد به سه شکل α، β و ɤ یافت میشود. پایدارترین فرم آن در دما و فشار اتاق فرم آلفای آن است. فرم آلفای این ترکیب مکعبی بوده و به عنوان ساختار نوع NaCl شناخته میشود و در گروه فضایی Fm3m قرار می گیرد. در فشار GPa 3/6 ساختار آن به فرم تتراگونال ( فرم بتا در گروه فضایی P421c ) و در فشار GPa 9/8 به فرم اورتو رومبیک ( فرم گاما در گروه فضایی Pnma ) تبدیل میشود.
جهت سنتز تجاری سدیم بوروهیدرید از دو روش براوون - اشلسینگر ( Brown - Schlesinger ) و بایر ( Bayer ) استفاده می شود. در روش براوون - اشلسینگر سدیم بوروهیدرید در مقیاس صنعتی تهیه با روش ابتدایی اشلسینگر تهیه می شود. در این روش سدیم هیدرید که از واکنش سدیم با مولکولهای هیدروژن به دست می آید با تری متیل بورات در دمای بین 250 تا 270 درجه ی سانتیگراد واکنش می دهد.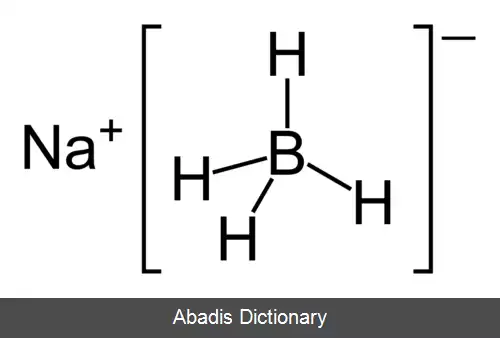
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاین ترکیب در دهه ی 1940 به وسیلهٔ ی H. I. Schlesinger کشف شد. H. I. Schlesinger به دنبال یافتن ترکیبات قرار اورانیوم بود. نتایج این تحقیق در سال 1953 از حالت محرمانه خارج شده و منتشر شد.
سدیم بورو هیدرید پودری میکرو کریستالی بی بو به رنگ سفید و یا خاکستری مایل به سفید است که از حالت توده ی آن تهیه می شود. این ماده با استفاده از کریستالیزاسیون دوباره از دیگلیم گرم در دمای 50 درجه ی سانتیگراد تخلیص می شود. سدیم بورو هیدرید در حلالهای پروتیک از قبیل الکل و آب قابل حل است. ترکیب سدیم بوروهیدرید با این حلالهای پروتیک باعث تولید مولکول هیدروژن می شود، اگرچه این واکنشها به نسبت آرام است. تجزیه ی کامل محلول متانول نزدیک به 90 دقیقه در دمای بیست درجه ی سانتیگراد طول میکشد. این ترکیب در محلولهای آبی خنثی و یا اسیدی تجزیه می شود، اما در pH=14 پایدار است.
سدیم بوروهیدرید یک ترکیب نمکی است که ار آنیون های تتراهدرال - BH4 تشکیل شده است. این ماده ی جامد به سه شکل α، β و ɤ یافت میشود. پایدارترین فرم آن در دما و فشار اتاق فرم آلفای آن است. فرم آلفای این ترکیب مکعبی بوده و به عنوان ساختار نوع NaCl شناخته میشود و در گروه فضایی Fm3m قرار می گیرد. در فشار GPa 3/6 ساختار آن به فرم تتراگونال ( فرم بتا در گروه فضایی P421c ) و در فشار GPa 9/8 به فرم اورتو رومبیک ( فرم گاما در گروه فضایی Pnma ) تبدیل میشود.
جهت سنتز تجاری سدیم بوروهیدرید از دو روش براوون - اشلسینگر ( Brown - Schlesinger ) و بایر ( Bayer ) استفاده می شود. در روش براوون - اشلسینگر سدیم بوروهیدرید در مقیاس صنعتی تهیه با روش ابتدایی اشلسینگر تهیه می شود. در این روش سدیم هیدرید که از واکنش سدیم با مولکولهای هیدروژن به دست می آید با تری متیل بورات در دمای بین 250 تا 270 درجه ی سانتیگراد واکنش می دهد.

wiki: سدیم تترا هیدروبورات
