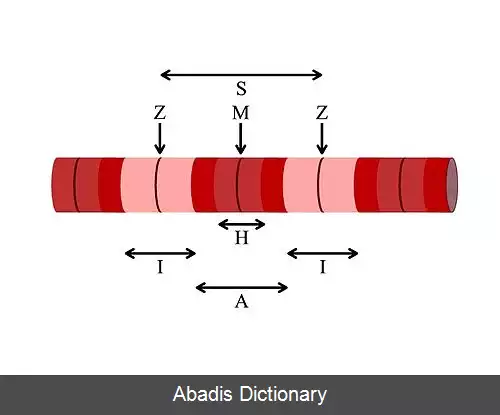
هر یاختهٔ ماهیچه ای ( میوسیت ) یا تار یا میون شامل میوفیبریل ( تارچه ) هاست که زنجیره های بسیار طولانی از سارکومرها هستند. سارکومرها واحدهای انقباضی سلول هستند. یک سلول از ماهیچه دوسر بازو ( یک نوع ماهیچه اسکلتی یا مخطط ) ۱۰۰٬۰۰۰ سارکومر دارد. میوفیبریل های سلول های ماهیچه صاف به شکل سارکومر سازماندهی نشده اند اما ساختار میوفیبریل ها در ماهیچهٔ قلبی مانند ماهیچهٔ اسکلتی از سارکومر است. سارکومرها از رشته های نازک و ضخیم تشکیل شده اند. رشته های نازک از فیلامان های اکتین تشکیل شده اند، درحالی که رشته های ضخیم از پروتئین های میوزین ساخته شده اند. سارکومرها اندامک یا هسته ندارند. در سارکومرها دو نوار I ( روشن ) و A ( تیره ) وجود دارد که به علت آرایش منظم میوفیلامنت های ضخیم و نازک ( به ترتیب متشکل از میوزین و اکتین ) بدین شکل درآمده است. اکتین و میوزین رشته هایی پروتئینی هستند. در بخش تیره سارکومر می توان میوزین و اکتین را با هم دید و در بخش وسطی سارکومر علاوه بر میوزین، پروتئین های دیگر را نیز می توان مشاهده کرد. مجموعه ای از سارکومرها تارچه را تشکیل می دهند.
هر میوفیلامنت ضخیم شامل ۲۰۰–۵۰۰ مولکول میوزین است. میوزین ها ناحیه مرکزی سارکومر یعنی نوار A را اشغال می کنند و میوزین یک مجموعه بزرگ با دو زنجیره سنگین یکسان و دو جفت زنجیره سبک است. زنجیره های سنگین در واقع پروتئین های حرکتی میله مانند و نازکی ( به طول ۱۵۰ نانومتر و ضخامت ۲ تا ۳ نانومتر ) هستند که با یکدیگر پیچ و تاب خورده و دم های میوزین را می سازند. زوائد یا سرهای کروی هم که در انتهای هر زنجیره سنگین وجود دارند را زنجیره های سبک به وجود می آورند. در واقع سرهای میوزین جایگاه هایی برای اتصال اکتین ( تشکیل پل عرضی ناپایدار بین اکتین و میوزین در حین انقباض ) و آدنوزین تری فسفات ( ATP ) هستند. به این عملِ سرهای میوزین، فعالیت ATPآزی اکتومیوزین ( Actomyosin ATPase activity ) گویند. صدها مولکول میوزین به گونه ای آرایش یافته اند که بخش میله ای فیلامنت های ضخیم با یکدیگر همپوشانی داشته و سرهای آن ها رو به هر دو انتهای فیلامنت های ضخیم هستند.
یک فیلامنت نازک خود شامل Fاکتین، تروپومیوزین و تروپونین است. Fاکتین خود شامل مونومرهای Gاکتین است که دارای یک محل اتصال به نام نقاط فعال برای میوزین است. تروپومیوزین ( Tropomyosin ) هم که یک نوع پروتئین تنظیم کننده هست، مارپیچی از دو زنجیره پلی پپتیدی است که در واقع جایگاه اتصال Gاکتین را می پوشاند و مانع از اتصال سر میوزین به جایگاه فعال ( Active site ) اکتین در حالت عادی می شود. تروپونین مجموعه ای از سه زیر واحد است: TnT که به تروپومیوزین متصل می شود؛ TnC که به یون های کلسیم وصل می گردد و TnI که تعاملات اکتین - میوزین را تنظیم می کند.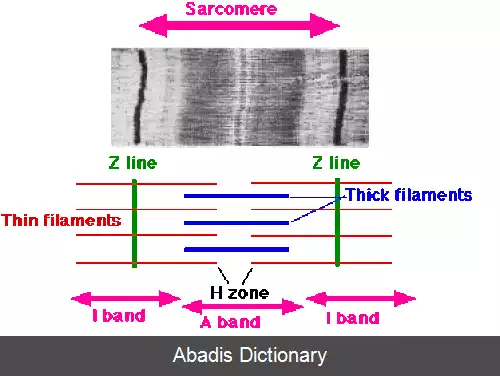
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفهر میوفیلامنت ضخیم شامل ۲۰۰–۵۰۰ مولکول میوزین است. میوزین ها ناحیه مرکزی سارکومر یعنی نوار A را اشغال می کنند و میوزین یک مجموعه بزرگ با دو زنجیره سنگین یکسان و دو جفت زنجیره سبک است. زنجیره های سنگین در واقع پروتئین های حرکتی میله مانند و نازکی ( به طول ۱۵۰ نانومتر و ضخامت ۲ تا ۳ نانومتر ) هستند که با یکدیگر پیچ و تاب خورده و دم های میوزین را می سازند. زوائد یا سرهای کروی هم که در انتهای هر زنجیره سنگین وجود دارند را زنجیره های سبک به وجود می آورند. در واقع سرهای میوزین جایگاه هایی برای اتصال اکتین ( تشکیل پل عرضی ناپایدار بین اکتین و میوزین در حین انقباض ) و آدنوزین تری فسفات ( ATP ) هستند. به این عملِ سرهای میوزین، فعالیت ATPآزی اکتومیوزین ( Actomyosin ATPase activity ) گویند. صدها مولکول میوزین به گونه ای آرایش یافته اند که بخش میله ای فیلامنت های ضخیم با یکدیگر همپوشانی داشته و سرهای آن ها رو به هر دو انتهای فیلامنت های ضخیم هستند.
یک فیلامنت نازک خود شامل Fاکتین، تروپومیوزین و تروپونین است. Fاکتین خود شامل مونومرهای Gاکتین است که دارای یک محل اتصال به نام نقاط فعال برای میوزین است. تروپومیوزین ( Tropomyosin ) هم که یک نوع پروتئین تنظیم کننده هست، مارپیچی از دو زنجیره پلی پپتیدی است که در واقع جایگاه اتصال Gاکتین را می پوشاند و مانع از اتصال سر میوزین به جایگاه فعال ( Active site ) اکتین در حالت عادی می شود. تروپونین مجموعه ای از سه زیر واحد است: TnT که به تروپومیوزین متصل می شود؛ TnC که به یون های کلسیم وصل می گردد و TnI که تعاملات اکتین - میوزین را تنظیم می کند.


wiki: سارکومر
