خوردگی گالوانیک ( به انگلیسی: Galvanic corrosion ) به خوردگی در اثر وجود اختلاف پتانسیل الکتریکی بین فلزات در ارتباط با یکدیگر گفته می شود. اختلاف پتانسیل باعث شارش الکترون ها بین این دو فلز می شود. در این حالت فلز دارای پتانسیل تعادلی کمتر، آند پیل الکتروشیمیایی را تشکیل داده و خورده می شود. فلز کاتد خورده نمی شود یا خوردگی آن بسیار کم می شود. در اتصال دو فلز غیر همجنس تشدید خوردگی آند را خوردگی گالوانیکی و کاهش خوردگی کاتد را حفاظت کاتدی گویند. به منظور کاهش یا به حداقل رساندن میزان خوردگی گالوانیکی از روش های تجربی گوناگون استفاده می شود. روش های معمول در این موارد به قرار زیر هستند:
الف ) انتخاب فلزاتی که تا حد امکان در جدول سری گالوانیک به هم نزدیکتر باشند.
ب ) اجتناب از تأثیر نامطلوب مساحت ها ( آند کوچک و کاتد بسیار بزرگ ) .
ج ) عایق کردن فلزات غیر همجنس تا حدی که امکان اجرای عملی آن وجود داشته باشد.
د ) انجام پوشش مناسب مخصوصاً در منطقهٔ آندی
ه ) استفاده از بازدارنده ها جهت کاهش خورندگی محیط
و ) اجتناب از اتصالات پیچی در مورد فلزاتی که در سری گالوانیکی از همدیگر خیلی دور باشند
ز ) طراحی قطعات طوری صورت گیرد که قسمت آندی را بتوان به راحتی تعویض نمود یا این قسمت ها به منظور دوام و عمر بیشتر، ضخیم تر ساخته شوند
ح ) تعبیه یک فلز ثالث در تماس با آن ها به طوری که نسبت به هر دو فلز قبلی، دارای پتانسیل الکتریکی بالاتری باشد ( خاصیت آندی بیشتر )
خوردگی گالوانیک ( یا خوردگی دو فلزی ) یک فرایند الکتروشیمیایی است که در آن یک فلز در حالی که در حضور یک الکترولیت در تماس با یک فلز دیگر می باشد دچار خوردگی می شود. نمونهٔ مشابه واکنش های گالوانیک در پیل های شیمیایی ( همان باتری های معمولی ) برای ایجاد ولتاژ الکتریکی مناسب برای تأمین انرژی وسایل الکتریکی قابل حمل وجود دارد. [ ۱]
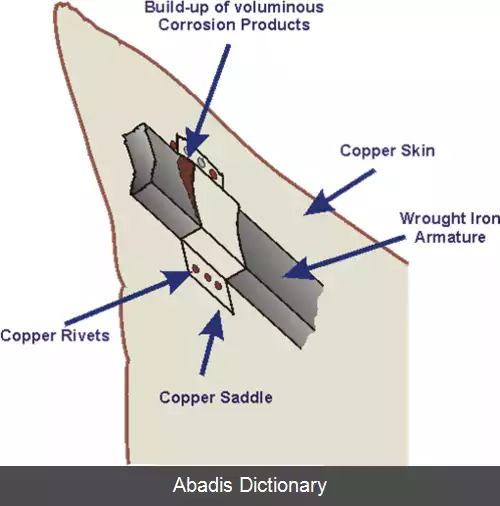
فلزات و آلیاژهای مختلف مواد دارای پتانسیل های الکترودی متفاوتی هستند، و زمانی که دو یا چند فلز یا آلیاژ مختلف در یک الکترولیت در تماس با یکدیگر قرار می گیرند، یک فلز نقش آند و دیگری نقش کاتد را ایفا خواهند کرد. اگر الکترولیت تنها شامل یون های فلزی باشد که به راحتی کاهش شیمیایی نمی یابند ( مانند یون یک بار مثبت سدیم و پتاسیم یا یون دو بار مثبت کلسیم، منیزیم و روی ) ، فرایند کاتد شامل کاهش یون هیدروژن مثبت از مولکول هیدروژن یا اکسیژن برای تشکیل یون منفی هیدروکسید خواهد بود. [ ۲] تفاوت پتانسیل الکتریکی میان میان واکنش هایی که در دو الکترود انجام می شود، محرک حملهٔ شتابدار به قسمت فلز آند سیستم می شود که به کاهش آن در الکترولیت می انجامد. این فرایند باعث این می شود که در فلز آند خوردگی سریع تر انجام شود و از خوردگی فلز کاتد جلوگیری شود. وجود یک الکترولیت و در واقع وجود یک مسیر عبوردهندهٔ الکتریکی بین فلزات برای وقوع خوردگی گالوانیک ضروری می باشد. الکترولیت امکانی را برای حرکت یون ها فراهم می آورد که این موضوع برای انباشته نشدن بار الکتریکی در قسمت های آند و کاتد سیستم و در نتیجه انجام فرایند شیمیایی خوردگی گالوانیک لازم می باشد. [ ۳]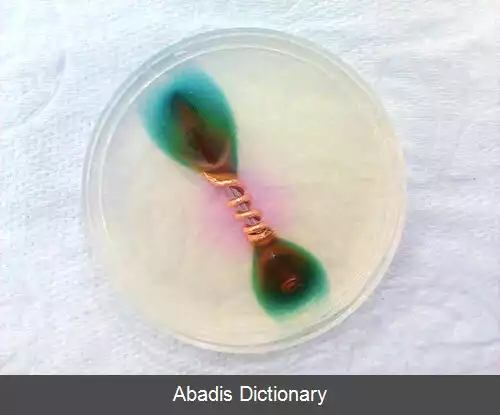

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفالف ) انتخاب فلزاتی که تا حد امکان در جدول سری گالوانیک به هم نزدیکتر باشند.
ب ) اجتناب از تأثیر نامطلوب مساحت ها ( آند کوچک و کاتد بسیار بزرگ ) .
ج ) عایق کردن فلزات غیر همجنس تا حدی که امکان اجرای عملی آن وجود داشته باشد.
د ) انجام پوشش مناسب مخصوصاً در منطقهٔ آندی
ه ) استفاده از بازدارنده ها جهت کاهش خورندگی محیط
و ) اجتناب از اتصالات پیچی در مورد فلزاتی که در سری گالوانیکی از همدیگر خیلی دور باشند
ز ) طراحی قطعات طوری صورت گیرد که قسمت آندی را بتوان به راحتی تعویض نمود یا این قسمت ها به منظور دوام و عمر بیشتر، ضخیم تر ساخته شوند
ح ) تعبیه یک فلز ثالث در تماس با آن ها به طوری که نسبت به هر دو فلز قبلی، دارای پتانسیل الکتریکی بالاتری باشد ( خاصیت آندی بیشتر )
خوردگی گالوانیک ( یا خوردگی دو فلزی ) یک فرایند الکتروشیمیایی است که در آن یک فلز در حالی که در حضور یک الکترولیت در تماس با یک فلز دیگر می باشد دچار خوردگی می شود. نمونهٔ مشابه واکنش های گالوانیک در پیل های شیمیایی ( همان باتری های معمولی ) برای ایجاد ولتاژ الکتریکی مناسب برای تأمین انرژی وسایل الکتریکی قابل حمل وجود دارد. [ ۱]
فلزات و آلیاژهای مختلف مواد دارای پتانسیل های الکترودی متفاوتی هستند، و زمانی که دو یا چند فلز یا آلیاژ مختلف در یک الکترولیت در تماس با یکدیگر قرار می گیرند، یک فلز نقش آند و دیگری نقش کاتد را ایفا خواهند کرد. اگر الکترولیت تنها شامل یون های فلزی باشد که به راحتی کاهش شیمیایی نمی یابند ( مانند یون یک بار مثبت سدیم و پتاسیم یا یون دو بار مثبت کلسیم، منیزیم و روی ) ، فرایند کاتد شامل کاهش یون هیدروژن مثبت از مولکول هیدروژن یا اکسیژن برای تشکیل یون منفی هیدروکسید خواهد بود. [ ۲] تفاوت پتانسیل الکتریکی میان میان واکنش هایی که در دو الکترود انجام می شود، محرک حملهٔ شتابدار به قسمت فلز آند سیستم می شود که به کاهش آن در الکترولیت می انجامد. این فرایند باعث این می شود که در فلز آند خوردگی سریع تر انجام شود و از خوردگی فلز کاتد جلوگیری شود. وجود یک الکترولیت و در واقع وجود یک مسیر عبوردهندهٔ الکتریکی بین فلزات برای وقوع خوردگی گالوانیک ضروری می باشد. الکترولیت امکانی را برای حرکت یون ها فراهم می آورد که این موضوع برای انباشته نشدن بار الکتریکی در قسمت های آند و کاتد سیستم و در نتیجه انجام فرایند شیمیایی خوردگی گالوانیک لازم می باشد. [ ۳]



wiki: خوردگی گالوانیک
