تیتراسیون کمپلکس به کمپلکس بودن آنالیت و تیترانت ربط دارد. عموماً شناساگر مورد نیاز با توجه به آنالیت یک کمپلکس ضعیف می باشد. برای مثال اریوکروم بلک تی برای تیتراسیون کلسیم و منیزیم و کی لیت برای تیتراسیون آهن در حلال استفاده می شود. [ ۱]
تیتراسیون کمپلکسومتری نوعی تجزیه ولتامتری است که در آن از تشکیل یک کمپلکس رنگی برای نشان دادن نقطه انتهایی یک تیتراسیون استفاده می شود. تیتراسیون کمپلکسومتری به ویژه برای تعیین مخلوطی از یون های فلزی مختلف در محلول مفید است. معمولاً از شاخصی که قادر به ایجاد تغییر رنگ نامشخص است برای تشخیص نقطه پایانی تیتراسیون استفاده می شود.
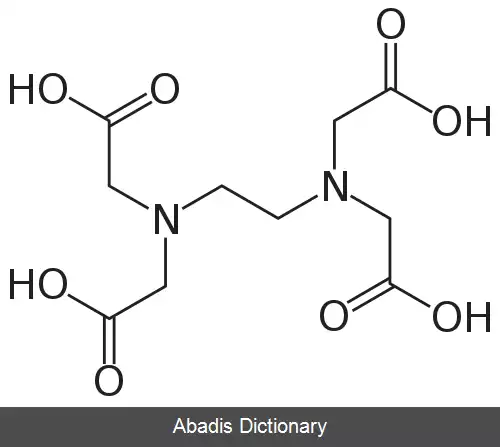
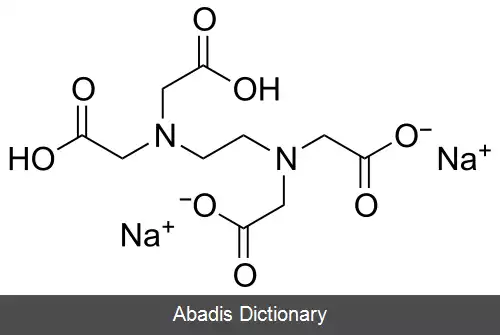
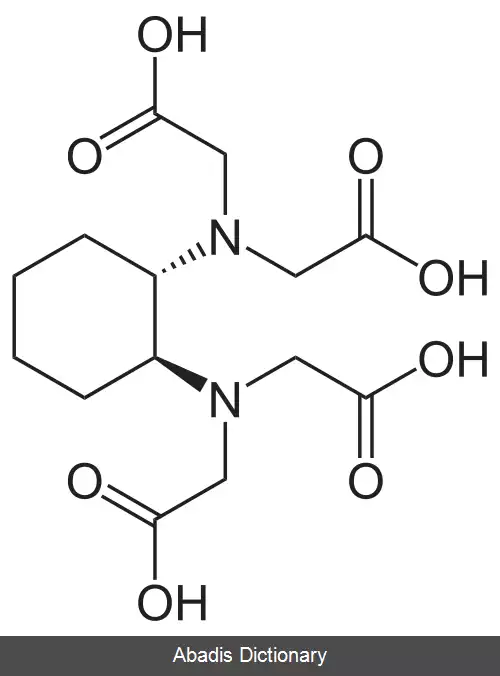
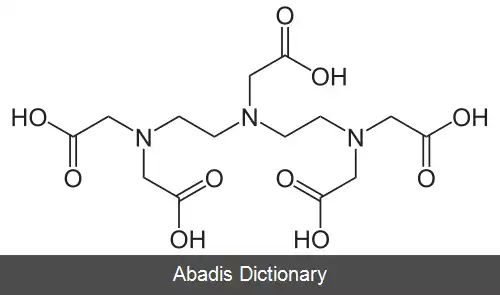
EDTA یا اتیلن دی آمین تترا استیک اسید، چهار گروه کربوکسیل و دو گروه آمین دارد که می توانند به عنوان اهدا کننده جفت الکترونی یا پایگاه های لوئیس عمل کنند. توانایی EDTA در اهدای بالقوه شش الکترون تنها جفت خود برای تشکیل پیوندهای کووالانسی کوردینانس به کاتیون های فلزی، EDTA را به یک لیگاند شش ضلعی تبدیل می کند. با این حال، در عمل EDTA معمولاً فقط جزئی از یونیزاسیون است و بنابراین کمتر از شش پیوند کووالانسی کوردینانس با کاتیونهای فلزی تشکیل می شود.
EDTA یک مجموعه هشت ضلعی را با اکثر کاتیونهای فلزی ۲+، M 2+ در محلول آبی تشکیل می دهد. دلیل اصلی استفاده از EDTA در استانداردسازی محلول های کاتیون فلزی ثابت تشکیل بالای آن برای اکثر کمپلکس های کاتیون - فلزی است، به این معنی که تعادل برای این واکنش:
انجام واکنش در محلول بافر پایه، H + را تشکیل می دهد و این باعث تشکیل محصول واکنش پیچیده کاتیونی EDTA - فلز نیز می شود.
برای انجام تیتراسیون کاتیونهای فلزی با استفاده از EDTA، تقریباً همیشه لازم است از یک کمپلکس شناساگر برای تعیین زمان رسیدن نقطه انتهایی استفاده شود. شناساگرهای رایج رزانه ارگانیک مانند فست سولفون بلک اف، اریوکروم بلک تی یا مورکسیدهستند. هنگام نقطه پایانی تغییر رنگ نشان می دهد که این شناساگر جانشین کاتیونهای فلزی در محلول شده است ( معمولاً توسط EDTA ) ، بدین ترتیب، شناساگر آزاد ( به جای کمپلکس فلزی ) به عنوان شناساگر نقطه انتهایی عمل می کند.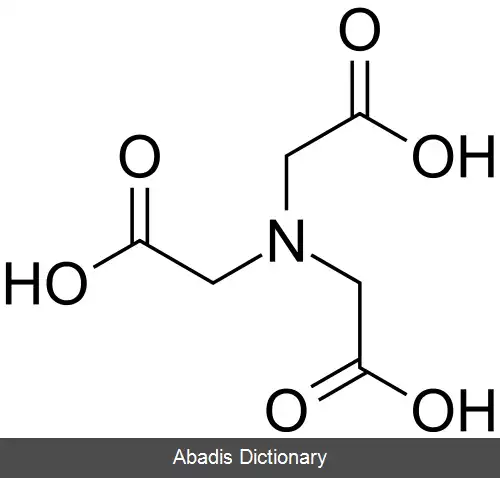
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفتیتراسیون کمپلکسومتری نوعی تجزیه ولتامتری است که در آن از تشکیل یک کمپلکس رنگی برای نشان دادن نقطه انتهایی یک تیتراسیون استفاده می شود. تیتراسیون کمپلکسومتری به ویژه برای تعیین مخلوطی از یون های فلزی مختلف در محلول مفید است. معمولاً از شاخصی که قادر به ایجاد تغییر رنگ نامشخص است برای تشخیص نقطه پایانی تیتراسیون استفاده می شود.
EDTA یا اتیلن دی آمین تترا استیک اسید، چهار گروه کربوکسیل و دو گروه آمین دارد که می توانند به عنوان اهدا کننده جفت الکترونی یا پایگاه های لوئیس عمل کنند. توانایی EDTA در اهدای بالقوه شش الکترون تنها جفت خود برای تشکیل پیوندهای کووالانسی کوردینانس به کاتیون های فلزی، EDTA را به یک لیگاند شش ضلعی تبدیل می کند. با این حال، در عمل EDTA معمولاً فقط جزئی از یونیزاسیون است و بنابراین کمتر از شش پیوند کووالانسی کوردینانس با کاتیونهای فلزی تشکیل می شود.
EDTA یک مجموعه هشت ضلعی را با اکثر کاتیونهای فلزی ۲+، M 2+ در محلول آبی تشکیل می دهد. دلیل اصلی استفاده از EDTA در استانداردسازی محلول های کاتیون فلزی ثابت تشکیل بالای آن برای اکثر کمپلکس های کاتیون - فلزی است، به این معنی که تعادل برای این واکنش:
انجام واکنش در محلول بافر پایه، H + را تشکیل می دهد و این باعث تشکیل محصول واکنش پیچیده کاتیونی EDTA - فلز نیز می شود.
برای انجام تیتراسیون کاتیونهای فلزی با استفاده از EDTA، تقریباً همیشه لازم است از یک کمپلکس شناساگر برای تعیین زمان رسیدن نقطه انتهایی استفاده شود. شناساگرهای رایج رزانه ارگانیک مانند فست سولفون بلک اف، اریوکروم بلک تی یا مورکسیدهستند. هنگام نقطه پایانی تغییر رنگ نشان می دهد که این شناساگر جانشین کاتیونهای فلزی در محلول شده است ( معمولاً توسط EDTA ) ، بدین ترتیب، شناساگر آزاد ( به جای کمپلکس فلزی ) به عنوان شناساگر نقطه انتهایی عمل می کند.






wiki: تیتراسیون کمپلکسومتری
