تکامل استوالد پدیده ای است که در محلول های جامد یا سل های مایع مشاهده می شود که تغییر یک ساختار ناهمگن را در طول زمان توصیف می کند، یعنی کریستال های کوچک یا ذرات سل حل می شوند و دوباره روی بلورها یا ذرات سل بزرگ تر رسوب می کنند. [ ۳]
انحلال کریستال های کوچک یا ذرات سل و رسوب مجدد گونه های محلول بر روی سطوح بلورهای بزرگتر یا ذرات سل اولین بار توسط ویلهلم اوستوالد در سال 1896 توصیف شد. [ ۴] [ ۵] برای سیستم های کلوئیدی، رسیدن استوالد در امولسیون های آب در روغن نیز یافت می شود، در حالی که لخته سازی در امولسیون های روغن در آب یافت می شود. [ ۶]
این فرآیند خودبه خودی که از نظر ترمودینامیکی هدایت می شود به این دلیل رخ می دهد که ذرات بزرگ تر از ذرات کوچک تر از نظر انرژی بیشتر مورد علاقه هستند. [ ۷] این از این واقعیت ناشی می شود که مولکول های روی سطح یک ذره از نظر انرژی پایدارتر از مولکول های موجود در داخل هستند.
یک کریستال مکعبی از اتم ها را در نظر بگیرید: همه اتم های داخل به 6 همسایه متصل هستند و کاملاً پایدار هستند، اما اتم های روی سطح فقط به 5 همسایه یا کمتر متصل هستند، که باعث می شود این اتم های سطحی پایداری کمتری داشته باشند. ذرات بزرگ از نظر انرژی مطلوب تر هستند زیرا، در ادامه با این مثال، اتم های بیشتری به 6 همسایه پیوند می خورند و اتم های کمتری در سطح نامطلوب قرار دارند. همانطور که سیستم سعی می کند انرژی کلی خود را کاهش دهد، مولکول های روی سطح یک ذره کوچک ( از نظر انرژی نامطلوب، تنها با 3 یا 4 یا 5 همسایه پیوند خورده ) تمایل به جدا شدن از ذره و انتشار در محلول دارند.
معادله کلوین رابطه بین شعاع انحنا و پتانسیل شیمیایی بین سطح و حجم داخلی را توصیف می کند: Δ μ = 2 σ ν a t r جایی که μ مربوط به پتانسیل شیمیایی است، σ به کشش سطحی، ν a t به حجم مولی و r به شعاع ذره. اگر فازهای مایع و جامد در تعادل باشند، پتانسیل شیمیایی یک محلول ایده آل را می توان تابعی از غلظت املاح نیز بیان کرد.
μ = K B T l n ( C e q )
جایی که K B مطابق با ثابت بولتسمان است، T مطابق دما و C e q مطابق غلظت املاح در محلولی که فاز جامد و مایع در آن در تعادل هستند.
از ترکیب هر دو عبارت معادله زیر به دست می آید: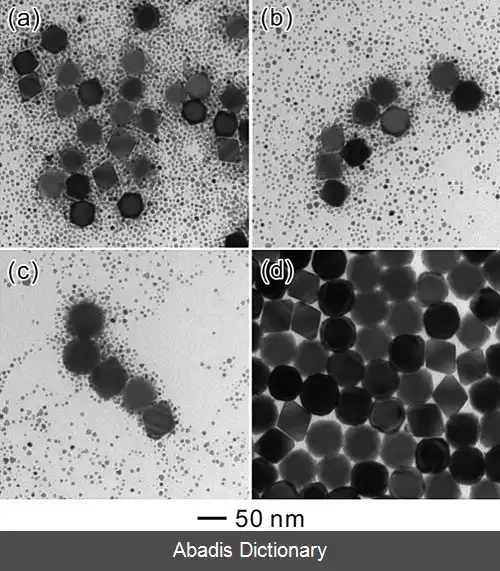

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفانحلال کریستال های کوچک یا ذرات سل و رسوب مجدد گونه های محلول بر روی سطوح بلورهای بزرگتر یا ذرات سل اولین بار توسط ویلهلم اوستوالد در سال 1896 توصیف شد. [ ۴] [ ۵] برای سیستم های کلوئیدی، رسیدن استوالد در امولسیون های آب در روغن نیز یافت می شود، در حالی که لخته سازی در امولسیون های روغن در آب یافت می شود. [ ۶]
این فرآیند خودبه خودی که از نظر ترمودینامیکی هدایت می شود به این دلیل رخ می دهد که ذرات بزرگ تر از ذرات کوچک تر از نظر انرژی بیشتر مورد علاقه هستند. [ ۷] این از این واقعیت ناشی می شود که مولکول های روی سطح یک ذره از نظر انرژی پایدارتر از مولکول های موجود در داخل هستند.
یک کریستال مکعبی از اتم ها را در نظر بگیرید: همه اتم های داخل به 6 همسایه متصل هستند و کاملاً پایدار هستند، اما اتم های روی سطح فقط به 5 همسایه یا کمتر متصل هستند، که باعث می شود این اتم های سطحی پایداری کمتری داشته باشند. ذرات بزرگ از نظر انرژی مطلوب تر هستند زیرا، در ادامه با این مثال، اتم های بیشتری به 6 همسایه پیوند می خورند و اتم های کمتری در سطح نامطلوب قرار دارند. همانطور که سیستم سعی می کند انرژی کلی خود را کاهش دهد، مولکول های روی سطح یک ذره کوچک ( از نظر انرژی نامطلوب، تنها با 3 یا 4 یا 5 همسایه پیوند خورده ) تمایل به جدا شدن از ذره و انتشار در محلول دارند.
معادله کلوین رابطه بین شعاع انحنا و پتانسیل شیمیایی بین سطح و حجم داخلی را توصیف می کند: Δ μ = 2 σ ν a t r جایی که μ مربوط به پتانسیل شیمیایی است، σ به کشش سطحی، ν a t به حجم مولی و r به شعاع ذره. اگر فازهای مایع و جامد در تعادل باشند، پتانسیل شیمیایی یک محلول ایده آل را می توان تابعی از غلظت املاح نیز بیان کرد.
μ = K B T l n ( C e q )
جایی که K B مطابق با ثابت بولتسمان است، T مطابق دما و C e q مطابق غلظت املاح در محلولی که فاز جامد و مایع در آن در تعادل هستند.
از ترکیب هر دو عبارت معادله زیر به دست می آید:



wiki: تکامل استوالد
